Ⅰ.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
(1)反应前2 min的平均速率ν(Z)= ,该温度下此反应的平衡常数K=
(2)其他条件不变,若降低温度,反应达到新平衡前ν(逆) ν(正)(填“>”,“<”或“=”)
(3)其他条件不变,若再充入0.2 mol Z,平衡时X的体积分数 (填“增大”,“减小”或“不变”)
Ⅱ.下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
请根据上述信息回答:
(1)H中含氧官能团的名称是____ ____,B→I的反应类型为___ _____。
(2)只用一种试剂鉴别D、E、H,该试剂是____ ____。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为__ ______。
(4)D和F反应生成X的化学方程式为______ _________。
氮的固定是指将氮元素由游离态转化为化合态的过程。
I.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g) 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的ΔH 0。(填“>”、“=”或“<”)
II.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定——电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入______极(填“阴”或“阳”);向另一电极通入N2,该电极的反应式为__________________。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入______极(填“阴”或“阳”);向另一电极通入N2,该电极的反应式为__________________。
III.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6 H2O (g) 4NH3(g)+3O2(g) ΔH=Q kJ/mol
4NH3(g)+3O2(g) ΔH=Q kJ/mol
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氮气的体积分数 与反应温度T的关系曲线如图所示,
与反应温度T的关系曲线如图所示,
则上述反应的Q ________0(填“>”、“<”或“=”)。
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH3OCH3 (g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
________(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将__________;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为____________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:
请写出电解过程中Y电极附近观察到的现象 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
(共16分)
Ⅰ.(10分)已知2A(g)+B(g)  2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
(1)比较a b( 填 > 、 = 、 < )
(2)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,C物质的浓度 (填>、=、<)w mol/L,a、b、c之间满足的关系式为 (用含a、b、c的代数式表示)。
(3)能说明该反应已经达到平衡状态的是 。
a、V(C)=2V(B); b、容器内压强保持不变
c、V逆(A)=2V正(B) d、容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和lmolB,500℃时充分反应达平衡后,放出热量d kJ,则d b ( 填 > 、 = 、 < ),
Ⅱ.用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),
NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
(1)电池放电时,负极的电极反应式为_______
(2)充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________。
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)  2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。 据此判断:
据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右
图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)  =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)  =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。
写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a)。
已知一定温度和压强下,在起始容积为V L的容器中充入1 mol A和1 mol B,保持恒温恒压下反应:A(g)+B(g)  C(g) △H>0。达到平衡时,C的体积分数为40%。试回答:
C(g) △H>0。达到平衡时,C的体积分数为40%。试回答:
(1)升温时,C的反应速率 (填“加快”、“减慢”或“不变)。
(2)若使温度、压强在上述条件下恒定不变,平衡时在密闭容器中继续充入2 mol A和2 mol B,则反应再次达到平衡时,C的体积分数是
(3)若反应在恒温恒容条件下进行并达到平衡,保持其他条件不变,向容器中通入稀有气体,请在右图中画出通入稀有气体后的正逆反应速率随时间的变化图像,并标出v(正)、v(逆)及其关系。
(10分)硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度(℃) 450 500 550 600
SO2的转化率(%) 97.5 95.8 90.50 80.0
(1)由表中数据判断H 0(填“>”、“=”或“<”)。
(2)能判断该反应已达到平衡状态的依据是 (填序号)。
a.混合气体中各组分的质量不变
b.c(SO2)=c(SO3)
c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是 。②此时的温度是 ℃。
③此温度下的平衡常数K= (可用分数表示)。
(10分) 氨的合成是重要的一项化工生产。已知合成氨有关能量变化的图像如图1。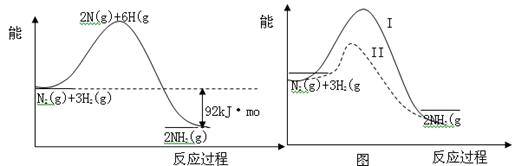
(1)反应 N2(g)+3H2(g) 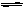 2NH3(g) △H= ;
2NH3(g) △H= ;
(2)化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(kJ·mol-1):H—H:436,N≡N:946,则N—H的键能是 kJ·mol-1;
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 ;
(4)在一个密闭容器中加入1molN2、3mol H2,一定条件下充分反应,其热效应始终小于92 kJ,请说明原因 ;
(5)在一个密闭容器中加入amolN2、bmol H2,达到平衡时n(N2):n(H2)=1:3,则a:b= 。
(6分)工业上常用天然气作为制备CH3OH的原料。已知:
①CH4(g)+O2(g)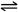 CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
②CH4(g)+ H2O(g) 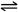 CO(g)+3H2(g) △H=+250.3 kJ/mol
CO(g)+3H2(g) △H=+250.3 kJ/mol
③CO(g)+2H2(g)  CH3OH(g) △H=-90.0 kJ/mol
CH3OH(g) △H=-90.0 kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为_____________。
(2)向V L恒容密闭容器中充入a mol CO与2a mol H2,在不同压强下合成甲醇。CO 的平衡转化率与温度、压强的关系如下图所示: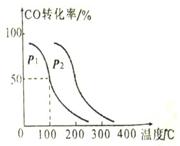
①压强P1____P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为________(用含a、V的代数式表示)。
写出下列反应的热化学方程式
(1)在25℃,101 Kpa 下1 mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为1366.8 kJ,试写出表示乙醇燃烧的热化学方程式:____
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。已知:N2(g)+2O2 (g)=2NO2(g) △H=+67.7kJ/mol
2N2H4(g)+2NO2 (g)=3N2(g)+4H2O(g)△H= 一1135.7kJ/ mol
则肼完全燃烧的热化学方程式为 。
(3)高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO(g)=" Fe(s)+" CO2(g) △H>0。
①此反应的平衡常数表达式为 ;
②温度升高平衡常数K值 (填“增大”、“减小”、或“不变”)
③已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“不是”)处于化学平衡状态,此时化学反应速率是v正 v逆(填“<”、“>”或“=”)。
(6分)请回答下列问题:
(1)在一定温度下,下列叙述是可逆反应A(g)+3B(g)  2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时生成3amol B;
③A、B、C的浓度不再变化;
④A、B、C的分子数目比为1:3:2 ;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦单位时间消耗amol A,同时生成3amol B;
⑧单位时间内生成a mol C,同时生成 mol B
mol B
(2)在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向移动”或“逆向移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向移动”或“逆向移动”)
| 加入的物质 |
少量NH4Cl固体 |
少量KOH溶液 |
| c(OH-)的变化 |
|
|
| 平衡移动方向 |
|
|
(12分)恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
O2 (g) + 2SO2(g) 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n(O2) = 4mol,n(SO3) = 4mol,计算a的值为 。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)= 。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是 。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: >
> ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 ;用O2表示从0~2 s内该反应的平均速率v= ;

(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(12分)
向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g) 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
(1)平衡后继续向容器中充入惰性气体,平衡_________移动。(填“正向”,“逆向”,“不”)
(2)用A表示2分钟内平均反应速率 ,A在第1分钟平均速率 第2分钟平均速率(填“<”、“>”、“=”)。
(3)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(4)为了增大B的转化率,可采取的措施是_________(用序号填空)
①加入A
②加入B
③加压
④再加入1.6 mol A+ 0.8 mol B
⑤将C分离出容器
(5)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B
②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D
④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数表达式K= 。
②30min后,只改变某一条件,反应重新达到平衡,
根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入合适的催化剂 b.加入一定量的活性炭
c.通入一定量的NO d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.反应体系的压强不再发生改变
d.混合气体的密度不再发生改变
试题篮
()