(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 平衡浓度(mol·L-1) |
0.5 |
0.5 |
2.0 |
2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H="_______" kJ·mol-1
2CO(g)+2H2(g) 的 △H="_______" kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4 CH3COOH, 请回答:
CH3COOH, 请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图。
250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
现有如图所示的转化关系,图中各物质均为常见物质,转化中有部分物质已省略。
上述物质中C是一种黑色磁性固体,F是极易溶于水且水溶液呈碱性的气体,H是红褐色沉淀,A、D、E均为单质,请回答下列问题:
(1)写出下列物质的化学式:A: 、E
(2)写出④中生成H的非氧化还原反应的离子方程式:
(3)在120℃、1大气压下将168gA和90gB放入1L,密封烧瓶中发生反应①,经过10min达到平衡,平衡后D的质量为4g(固体体积忽略不计),则用D表示10min内的平均反应速率为 ,该温度下此反应的平衡常数K= ,B的转化率是 。
(1)已知:下列两个热化学方程式:Fe(s) + 1/2O2(g)  FeO(s)
FeO(s)  =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)
Al2O3(s)  =-1675.7KJ/mol 则Al(s)的单质和FeO(s)反应的热化学方程式是_ 。
=-1675.7KJ/mol 则Al(s)的单质和FeO(s)反应的热化学方程式是_ 。
(2)右图表示在密闭容器中反应:2SO2+O2 2SO3;
2SO3;  <0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ; 
(3)若增大压强时,将反应速度变化情况画在c—d处
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l) △H<0
N2O3(l) △H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。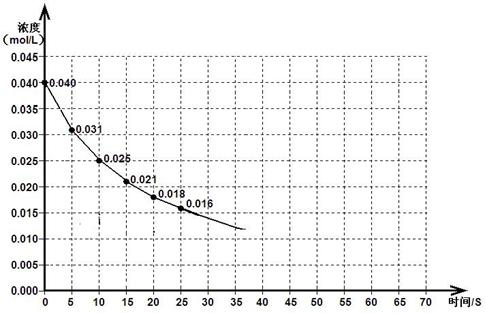
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向______ _移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
(11分)高炉炼铁过程中发生的主要反应为:
| 温度/℃ |
1 000 |
1 150 |
1 300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g).该反应在不同
Fe(s)+CO2(g).该反应在不同
温度下的平衡常数如下:请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A减少Fe的量 B增加Fe2O3的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+ KCl(l) NaCl(l)+ K(g) ΔH>0 该反应的平衡常数可表示为:K =" C(K)" 各物质的沸点与压强的关系见下表。
NaCl(l)+ K(g) ΔH>0 该反应的平衡常数可表示为:K =" C(K)" 各物质的沸点与压强的关系见下表。
| 压强(kPa) |
13.33 |
53.32 |
101.3 |
| K的沸点(℃ ) |
590 |
710 |
770 |
| Na的沸点(℃ ) |
700 |
830 |
890 |
| KCl的沸点(℃ ) |
|
|
1437 |
| NaCl的沸点(℃ ) |
|
|
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 ;
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 (任写一条);(3)常压下,当反应温度升高至 900℃ 时,该反应的平衡常数可表示为:K = 。
某化学反应2A(g)  B(g)+D(g)在三种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在三种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 |
  时间 时间浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
(1)在实验1,反应在10至20分钟时间内用A表示表示该反应的平均速率为_______
(2)在实验2,A的初始浓度c2=____mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)比较实验3和1,则正反应是____反应(填吸热、放热),理由是___________________
请结合化学反应原理回答下列问题:
(1)硫酸的产量通常用来衡量一个国家的化学工业发展水平,硫酸工业生产中涉及反应之一为:
2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。

①压强:P1 P2(填“>”、“=”或“<”)。
②200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 |
SO2 |
O2 |
SO3 |
| 浓度(mol/L) |
0.4 |
1.2 |
1.6 |
能说明该反应达到化学平衡状态的是 。
a.反应速率υ(SO2)=υ(SO3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和O2的体积比保持不变
计算上述反应在0~10min内,υ(SO2)= 。
(2)SO2与氢氧化钠溶液反应可以生成亚硫酸氢钠,已知25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)工业制取硫酸还可以利用电化学原理:
①工业生产中用SO2为原料制取硫酸可以利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的正极电极反应式_____________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式_________。

在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是 ,H2的转化率是 ,容器中H2的平衡浓度是 mol/L,该温度下平衡常数的数值为 。(用a、b、c表示出计算式即可)
一定条件下,某容积为1L的密闭容器中发生如下反应:C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)在(1)中若充入的是2.5 mol CO(g)和4 mol H2 (g),达到平衡后混合气体的平均相对分子质量为 ;若要求达到平衡后混合气体的平均相对分子质量始终大于该值,则充入的CO、H2混合气体的总质量m和总物质的量n必须满足的关系为 。
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
(1)该反应是 反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,
E2_____ (填“增大”“减小”“不变”)。
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2  2SO3
2SO3 
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。 SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。(填序号)
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)下图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:
________________________________________________________________________。
一密封体系中发生下列反应:N2 +3H2 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?
、 、
(3)下列各时间段时,氨的百分含量最高的是______.
| A.t0~t1 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
在体积为1 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A c(CO2)=c(CO) B K不变 C 容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
试题篮
()