在一密闭容器中加入A、B进行可逆反应:A(g) + B(g) mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
(1)此反应的正反应是 (放热、吸热)反应
(2)若保持其它条件不变,升高温度,C的产率将 (变大、变小);
(3)正反应是体积 (缩小、增大)的反应,m值为 ;
(4)若要提高A的转化率,可采取的措施是: (只写两个)。
(实验班做)
恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol, a="________" 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。nt(NH3) __________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= _____ 。
(4)原混合气体中,a:b=_____ 。
(5)将1molN2和3molH2合成NH3反应时,下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________ ;
A 容器内的总压强不随时间而变化
B反应后混合气体的密度不再发生变化
C三种气体的浓度相等且保持不变
D NH3的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化
(普通班做)
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
平衡时,X的转化率为 ;平衡时,Y的浓度为 ;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A容器内压强不再发生变化
B X的体积分数不再发生变化
C容器内气体原子总数不再发生变化
D相同时间内消耗2n mol的Z的同时消耗n mol的Y
E. 相同时间内消耗n mol的Y的同时消耗3n mol的X
(10分)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)  Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K = c(CO2)/c(CO),已知1100 ℃时K =0.263
Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K = c(CO2)/c(CO),已知1100 ℃时K =0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ;平衡常数K值 (选填“增大”“减小”或“不变”)。
(2)1100 ℃时测得高炉中c(CO2)="0.025" mol·L-1、c(CO)="0.1" mol·L-1,在这种情况下,该反应是否处于化学平衡状态 (选填“是”或“否”),此时,化学反应速率是v(正) v(逆)(选填“大于”“小于”或“等于”),其原因是 。
(10分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD,并测得C的浓度为0.4mol/L。由此推断:
xC(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于 。
(2)B的平衡浓度为 。
(3)A的转化率为 。
(4)生成D的反应速率 。
(5)如果增大反应体系的压强,则平衡体系中C的质量分数 。(填“增大”或“减小”或“不变”)
(4分)加热时,N2O5可按下列分解:N2O5 N2O3 + O2,其中N2O3又可按下列分解:N2O3
N2O3 + O2,其中N2O3又可按下列分解:N2O3 N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L, c(N2O)= mol/L,此时N2O5的分解率为 。
N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L, c(N2O)= mol/L,此时N2O5的分解率为 。
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2  2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
工业制硫酸生产流程如下图:
已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 ;
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为 ;
A.净化气体 B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变为97.2L,则SO2的转化率为 。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度(×10-3 mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
氨基甲酸铵分解反应的焓变ΔH 0(填“>”、“<”或“=”)。
可以判断该分解反应已经达到化学平衡的是 。(填字母)
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5 mol/L氨水的pH约为 。(已知lg3≈0.5)在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)= 。
在容积不变的密闭容器中,分别充入1.0 mol N2和3.0 mol H2,在不同温度下,任其发生反应:N2(g)+3H2(g) 2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
请回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是 。
(2)此可逆反应的正反应是 (填“放热”或“吸热”)反应。
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和化学平衡的角度说明理由: 。
近年来,随着人们对化石能源大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染被提上了日程。为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:
2H2(g)+CO(g) CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
| t/s |
0 |
500 |
1 000 |
| c(H2)/(mol·L-1) |
5.00 |
3.52 |
2.48 |
| c(CO)/(mol·L-1) |
2.50 |
|
|
(1)在500 s内用H2表示的化学反应速率是 。
(2)在1 000 s内用CO表示的化学反应速率是 ,1 000 s时CO的转化率是 。
(3)在500 s时生成的甲醇的浓度是 。
反应:aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: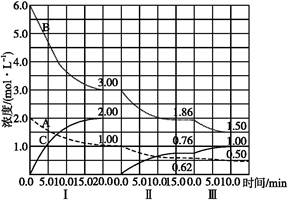
回答问题:
(1)反应的化学方程式中,a∶b∶c为 ;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 ;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
)高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1 000 |
1 150 |
1 300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
试题篮
()