有一化学反应2A  B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空: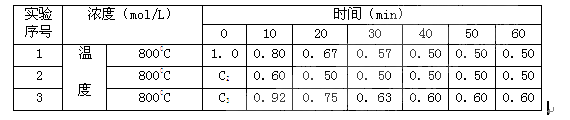
(1)在实验1,反应在0至20分钟时间内A的平均速率为_______mol/(L·min)。
(2)在实验2,A的初始浓度C2=____________mol/L,可推测实验2中隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3=_______mol/L,可推测实验3中隐含的条件是___________。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
已知反应:Fe(s)+CO2(g)═FeO(s)+CO(g)△H="a" kJ•mol﹣1,测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)该反应的化学平衡常数表达式为K= ,a 0(填“大于”、“小于”或“等于”).若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则此时v(CO)为 .
(2)若在700℃时该反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号).
A缩小反应容器的体积 B通入适量CO2 C加入适量铁
D升高温度到900℃ E使用合适的催化剂
化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 ;(填加深、变浅、不变)
④加入催化剂D,平衡 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 ;(填增大、减小、不变)
②增加B的量,A的转化率 .(填增大、减小、不变)
(10分)对于A+2B(气)  nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ="=" CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ="=" CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)="=" H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) ="=" CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
②在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
简答题(7分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2浓度为 ;
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号) ;
| A.容器内气体的总压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2nmolSO2的同时消耗nmolO2 |
E.相同时间内消耗2nmolSO2的同时生成nmolO2
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。

(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
a.v消耗(CH3OH)="2" v消耗(H2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡时c(H2)/ c(CH3OH)减小
(1)已知在K2Cr2O7的溶液中存在如下平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
(2)已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是__________(填序号)。
①生成物的产量一定增加
②生成物的体积分数一定增加
③反应物的浓度一定降低
④反应物的转化率一定增加
⑤正反应速率一定大于逆反应速率
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A 的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A 的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 |
时间 浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为 mol·(L·min)-1。
(2)在实验2中A的初始浓度C2= mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”“=”或“<”=,且C3 1.0 mol·L-1(填“>”“=”或“<”=。
(10分)氯气在298 K、100 kPa时,在1 L水中可溶解0.090 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)在上述平衡体系中加入少量NaCl固体,平衡将向________移动(填“正反应方向”、“逆反应方向”或“不”)。
(3)如果增大氯气的压强,氯气在水中的溶解度将________(填“增大”、“减小”或“不变”),平衡将向________移动。(填“正反应方向”、“逆反应方向”或“不”)
(4)在饱和氯水中加入石灰石可得到较大浓度的次氯酸溶液,请运用学过的化学原理进行解释(次氯酸、碳酸的平衡常数分别为:K=3×10-8、K1=4.4×10-7):
;写出氯水与石灰石反应的离子方程式: 。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②温度T时反应的平衡常数K2 =
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断的理由是: 。
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是: 。
在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g)  2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6.
2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6.
(1)达到平衡时,C的物质的量浓度
(2)达到平衡时,A的转化率 。
(3)达到平衡时,用物质B表示的化学反应速率为 。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。
假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
| A.c ( H2 )减少; |
| B.平衡常数K增大; |
| C.CH3OH 的物质的量增加; |
| D.正反应速率加快,逆反应速率减慢; |
E.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,
则:Co2+在阳极的电极反应式为: ;除去甲醇的离子方程式为 。
试题篮
()