氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图;请写出NO2和CO反应的热化学方程式____________。
(2)在固定体积的密闭容器中,进行如下化学反应3A(s)+4B(g) 4C(g) △H>0 ,其平衡常数K与温度T的关系如下表:
4C(g) △H>0 ,其平衡常数K与温度T的关系如下表:

①该反应的平衡常数表达式: K=________________。
②试判断K1____________K2(填写“>”,“=”或“<”)。
③下列各项能说明该反应已达到平衡状态的是 ___________ (填字母)。
a.容器内B、C的浓度之比为1︰1
b.v(B)正=v(C)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是____________。
2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是____________。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在l L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=___________,以NH3表示该过程的反应速率v(NH3)=______________。
一定温度下在体积为5L的密闭容器中发生可逆反应.
(1)若某可逆反应的化学平衡常数表达式为:K=c(CO)×c(H2)/c(H2O)
(1)写出该反应的化学方程式:_______________;
(2)能判断该反应一定达到化学平衡状态的依据是____________(填选项编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(1)t1~t2这段时间内的化学反应速率v(H2)=__________.
(2)若继续加入2mol Fe(s),则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2的物质的量为____________mol.
(3)该反应的逆反应速率随时间变化的关系如右图.t1时改变了某种条件,改变的条件可能是__________(只要写其中一种答案即可)
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

(1)当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为 。N2的转化率
(3)T1温度下该反应的化学平衡常数K1= 。
(4)500℃时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L, c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态______(填是或否),此时反应速率是v正________v逆(填 >, <, =).
(5)根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
已知:①2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③CO的燃烧热△H =-c kJ·mol-1。
写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是

a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的  。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的  。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
已知2A(g)+B(g) 2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
(1)比较a b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”“=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后, 吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ω mol/L,a、b、c之间满足何种关系 (用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是
A.4 mol A和2 mol B B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B D.6 mol A和4 mol B
(4)将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”)
(5)一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”“变大”“变小”或“无法确定”)。
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=_____,反应
CO2(g)+H2(g)的平衡常数K2=_____,反应 CO2(g)+
CO2(g)+ H2(g)
H2(g)
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)________v(逆)(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如图所示:

右边Cu电极反应式是
a电极的电极反应式
在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体
b.适当升高温度
c.增大CO2的浓度
d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
A.容器中压强不变
B.混合气体中 c(CO)不变
C.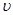 正(H2)=
正(H2)=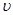 逆(H2O)
逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 ,CO2的物质的量为 。
A.等于1.0mol
B.大于1.0mol
C.大于0.5mol,小于1.0mol
D.无法确定
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ: 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。

(1)前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为 (保留两位小数,注意要写单位)。
(2)下列措施中,既能使反应加快,又能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是 。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡 (填“正向”、“逆向”或“不”)移动。
Ⅱ:利用CO2(g)+CH4(g) 2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
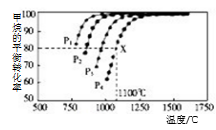
(5)下列事实能说明该反应达到平衡的是( )
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)= 2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是 。
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1 mol的CH4与CO2,相同的温度下充分反应达到平衡后,放出热量Q2 kJ,
则Q1 Q2(填 “>”“=”或“<”)
Ⅲ: 设反应①Fe(s)+CO2(g) FeO(s)+CO(g) 和反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 和反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(8)现有反应CO2(g)+H2(g) CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用水煤气合成二甲醚,总反应为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=﹣246.4kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是 (填字母代号).
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓度
(2)该反应的化学平衡常数表达式K= .温度升高平衡常数(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3mol H2、3mol CO、1mol CH3OCH3、1mol CO2,在一定温度和压强下发生反应:
3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.问:①反应开始时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②平衡时n(CH3OCH3)= ,平衡时CO的转化率为 .
③在该反应条件下能判断反应达到化学平衡状态的依据是 (填编号).
| A.v(CO)=3v(CO2) |
| B.生成a mol CO2的同时消耗3a mol H2 |
| C.c(CO2)=c(CO) |
| D.混合气体的平均相对分子质量不变 |
E.气体的密度不再改变
F.气体的总质量不再改变
硫-氨热化学循环制氢示意图如下:

(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g), H=+177kJ•mol-1……(a)
H=+177kJ•mol-1……(a)
2SO3(g) 2SO2(g) + O2(g),
2SO2(g) + O2(g), H="+196" kJ•mol-1……(b)
H="+196" kJ•mol-1……(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。

i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度 D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: 甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
(1)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(2)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是: 。

甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 |
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:

① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
③若右图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式 ,净化含1mol甲醇的水燃料电池需消耗KOH mol。
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g) ⇌CH3OH(g) △H=-90.8 kJ·mol-1
(1)已知:2H2(g)+O2(g)=2H2O △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) △H=-241.8 kJ·mol-1
则CH3OH(g)+O2(g)=CO(g)+2H2O(g)的反应热△H= kJ·mol-1。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应:CH4(g)+ H2O(g)=CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应的平衡常数为 。
(3)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ;在制备H2时最好控制n(O2)/n(CH3OH)= 。

试题篮
()