某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
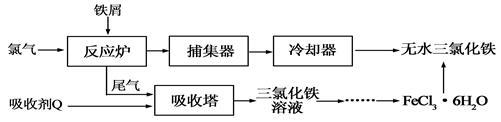
(1)试写出吸收塔中吸收剂Q反应的离子方程式: 。
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。再由FeCl3·6H2O晶体得到无水FeCl3的操作是: 。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=4×10-38)。
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L•min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生反应。
(1)生成了 molSO3,SO2的转化率为 。
(2)平衡时容器内气体的总物质的量为 mol。
(3)平衡时SO2的浓度是 mol/L。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2  CH3OH
CH3OH
图1表示该反应进行过程中的能量变化:
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式 。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:c(HCOO-)<c(Na+)时,则反应的情况可能为 。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应
C.NaOH过量
已知T K和P kPa时,在容积为V L的密闭容器中充有1 mol A和1 mol B,保持恒温恒压,使反应: A(g)+B(g) C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
(1)若使温度和压强在上述条件下恒定不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时,容器的体积为________,C的体积分数为________。
(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1 mol A和1 mol B反应达到平衡状态时, C的体积分数仍然为40%,则该密闭容器的体积为________。
下列各组反应哪几组是可逆反应?为什么?
(1)2H2+O2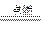 2H2O与2H2O
2H2O与2H2O 2H2↑+O2↑
2H2↑+O2↑
(2)NH3+H2O====NH3·H2O与NH3·H2O====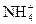 +OH-
+OH-
(3)CaCO3(s)====CaCO3(aq)与CaCO3(aq)====CaCO3(s)
(4)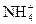 +OH-====NH3·H2O与NH3·H2O====
+OH-====NH3·H2O与NH3·H2O==== +OH-
+OH-
(5)2NH3 3H2+N2与N2+3H2
3H2+N2与N2+3H2 2NH3
2NH3
(6)SO2+H2O====H2SO3与H2SO3====SO2+H2O
(7)2SO2+O2 2SO3与2SO3
2SO3与2SO3 2SO2+O2
2SO2+O2
(8)2HI H2↑+I2↑与H2+I2
H2↑+I2↑与H2+I2 2HI
2HI
恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a= 。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为 。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)= 。
(4)原混合气体中a : b= 。
(5)达到平衡时,N2和H2的转化率 (N2):
(N2):  (H2)= 。
(H2)= 。
(6)平衡混合气体中n(N2): n(H2): n(NH3)= 。
(10分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)  Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37°时,1.0 L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L—1,其中尿酸分子的浓度为5.0×10—4mol·L—1,该病人尿液的c(H+)为 ,PH 7(填“>”、“=”或“<”)。
(1)在 H,
H, H,
H, H,
H, Mg,
Mg, Mg,
Mg, O,
O, O,
O, O中共有______种元素,______种原子,中子数最多的是 。D218O的相对分子质量是______。
O中共有______种元素,______种原子,中子数最多的是 。D218O的相对分子质量是______。
(2)人类的生活和生产活动,都离不开能源。在石油、电能、风能、煤碳、天然气、秸杆、水力、水煤气这些能源中,属于“二次能源”的(两种)是____,_ (共1分)属于“不再生能源”的(三种)是___ , , _(共1分)。
(3)化学反应的限度是当_ _____和 __相等,反应物和生成物的 _ ____保持不变时,所达到的一种看似 的“平衡状态”。
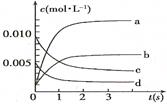
某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: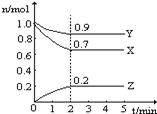
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应 ②逆反应 ③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)。体系中,n(NO)随时间的变化如表:
2NO2(g)。体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: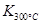 >
>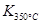 ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
某些天然气开采中含有H2S气体,为了安全、有效地利用这一资源,提高经济价值,工业上可以采取多种处理方式。
Ⅰ.吸收:
(1)加工过程中常用氨水吸收H2S,产物为NH4HS,请写出对应的化学方程式: 。
Ⅱ.再利用:加工过程中产生的H2S废气可用来制H2,既廉价又环保。工业上采用以下两种方法制备H2
1高温热分解法
已知:H2S(g) H2(g)+S(g) △H
H2(g)+S(g) △H
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。请回答:

(2)△H 0(填 “>”或者“<”),你判断的依据是: 。
ii.图中a为H2S的平衡转化率与温度关系曲线,
(3)据图计算985℃时H2S按上述反应分解的平衡常数K=________
2电化学法
已知:该法制氢过程的示意图如右,FeCl3溶液可作为H2S的吸收液。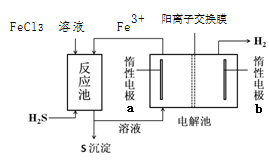
请回答:
(4)反应池中发生反应的离子方程式为_____________。
(5)请结合化学用语解释说明该装置能够产生H2的原因 。
(6)该装置除了能够制氢外,还具有何种优点?请你评价 。
试题篮
()