铁及其化合物与生产、生活关系密切。
(1)写出铁红(Fe2O3)的一种用途: 。
(2)写出利用FeCl3溶液制备氢氧化铁胶体的离子方程式: ;
(3)已知t℃时,FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=
Fe(s)+CO2(g)的平衡常数K=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=
已知反应2HI(g)  H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
| 物质 |
HI |
H2 |
I2 |
| 浓度/(mol·L-1) |
0.40 |
0.60 |
0.60 |
请计算回答下列问题(写出计算过程,否则不得分):
(1)起始加入HI的物质的量 mol。
(2)达到平衡后HI的物质的量浓度 mol·L-1(请保留三位有效数字)。
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1∶4,计算平衡时HI的体积分数为 ,以及开始时H2(g)与I2(g)的体积比为 。
(10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要原料。
(1)在硫酸工业生产中,我国采用黄铁矿为原料(与氧气反应)生产SO2,进料前必须将黄铁矿粉碎,目的是________。
(2)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。
(3)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知在T2温度时:2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1,
2SO3(g);△H=-196.6kJ·mol-1,
①在T1温度时,该反应的平衡常数 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
②在T2温度时,开始在10L的密闭容器中加入4. 0 mol SO2(g)和10mol O2(g),一定条件下当反应达到平衡时共放出热量196.6kJ。此时二氧化硫的转化率为 。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1mol O2(g) |
| B.保持温度和容器体积不变,充入2mol SO3 (g) |
| C.降低温度 |
| D.在其他条件不变时,减小容器的容积 |
甲醇、二甲醚等被称为绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚(CH3OCH3)。
(1)已知1g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为32kJ,请写出二甲醚燃烧热的热化学方程式____________________________________________________________________。
(2)写出二甲醚碱性燃料电池的负极电极反应式 __________________________________。
(3)用合成气制备二甲醚的反应原理为:2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:

①a、b、c按从大到小的顺序排序为_________________,该反应的△H_______0(填“>”、“<”)。
②某温度下,将2.0molCO(g)和4.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是 ;
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值减小 D. 氢气的转化率减小
④ 某温度下,将4.0molCO和8.0molH2充入容积为2L的密闭容器中,反应达到平衡时,测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=__________。
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
(1)已知:下列两个热化学方程式:Fe(s) + 1/2O2(g)  FeO(s)
FeO(s)  =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)
Al2O3(s)  =-1675.7KJ/mol 则Al(s)的单质和FeO(s)反应的热化学方程式是_ 。
=-1675.7KJ/mol 则Al(s)的单质和FeO(s)反应的热化学方程式是_ 。
(2)右图表示在密闭容器中反应:2SO2+O2 2SO3;
2SO3;  <0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ; 
(3)若增大压强时,将反应速度变化情况画在c—d处
(1) 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
(2)已知①CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3="-1370" kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。
红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的离子方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到三种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
(1)420 K时,发生反应的化学方程式为__________________________,若反应中消耗1 mol Xe,则转移电子____________mol;
(2)600~800 K时,会发生反应:XeF6(g) XeF4(g)+F2(g),其反应热ΔH________0(填“>”、“=”或“<”),理由是_________________________________________________;(3)900 K时,容器中存在的所有组分__________________________________(填化学式)。
XeF4(g)+F2(g),其反应热ΔH________0(填“>”、“=”或“<”),理由是_________________________________________________;(3)900 K时,容器中存在的所有组分__________________________________(填化学式)。
在一定条件下,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
(1)若A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是________。
(2)若A、C是气体,增加B的量,平衡不移动,则B的状态为________。
(3)若A、C是气体,而且 m+n=p,增大压强可使平衡发生移动,则平衡向________(填“正”或“逆”)反应方向移动。
(4)若加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
(10分)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l) 2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是 。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g) 2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 。
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0 s~3 s内的平均反应速率v(N2O4)= mol·L-1·s-1。
(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,反应速率 ,该反应的反应热 (填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)= ,H2的转化率为 (保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.把气体的体积压缩至1L | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a 0。(填“大于”、“小于”或“等于”)
材料是人类赖以生存和发展的重要物质基础,铁和碳是生活中常见的材料。
(1)碳可用于制取水煤气:C(s)+H2O(g)=CO(g)+H2(g)。相同温度下,在体积均为2L的两个密闭容器(已加入足量的碳)中进行上述反应,反应容器分别用编号A、B表示。
①写出该反应的平衡常数的表达式:
②已知该温度下平衡常数K="1.5" mol·L-1,若向A容器中另加入一定量的水蒸气,经过一段时间后达到平衡,此时c(H2O)=0.1mol·L-1、c(CO)=0.5mol·L-1,则c(H2)= mol·L-1。
③若向B容器中再加入一定量的水蒸气,某一时刻测得体系中物质的量如下:n(H2O)=0.2mol、n(CO)=0.2mol、 n(H2)=0.8mol则此时该反应
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(2)钢铁在海水中常发生电化学腐蚀,其负极反应式为 ;
(3)利用右图装置,可以模拟铁的电化学防护,为减缓铁的腐蚀,若开关K置于b处则Fe应与电源的 极相连。若开关置于a处,则下列可用作X极材料的是 。
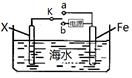
A.Zn B.Cu C.石墨 D.Pt
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s) 2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示:
2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示:

(1)已知该反应只有高温下能自发进行,则该反应的△H 0(填“>”、“<”或“=”)。
(2)在上述反应条件下,从反应开始到平衡,用V(B)= mol·L-1·min-1,500℃时的平衡常数K= ;
(3)在反应温度和容器体积不变的条件下,下列能说明上述反应达到平衡状态的是 ;
A.混合气体的压强保持不变 B.气体C的体积分数保持不变
C.混合气体的密度保持不变 D.B的正反应速率等于C的逆反应速率
(4)在500℃时,上述反应达到平衡后,在8min时将容器体积迅速压缩为1.0L,反应在12min建立新的平衡,画出8~15min内C气体物质的量浓度随时间变化的示意图。
试题篮
()