下列关于各图像的解释或结论正确的是

甲 乙 丙 丁
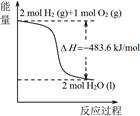
A.由甲可知:热化学方程式是H2(g) + O2(g) = H2O(g) △H=﹣241.8kJ/mol
O2(g) = H2O(g) △H=﹣241.8kJ/mol
B.由乙可知:对于恒温恒容条件下的反应2NO2(g) ⇌N2O4(g),A点为平衡状态
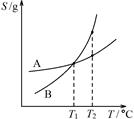
C.由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
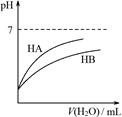
D.由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g) 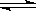 MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
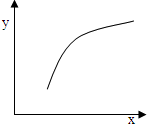
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
将0.5 mol SO2和0.2 mol O2置于密闭容器中发生反应:2SO2+O2 2SO3。下列关于该反应的说法正确的是
2SO3。下列关于该反应的说法正确的是
| A.最终可生成0.4 mol SO3 | B.当v正(O2)= v逆(SO2) = 0时一定达化学平衡 |
| C.升高温度反应速率减小 | D.缩小体积增大压强反应速率增大 |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
|
0.4 |
| 15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
下列事实不能用勒夏特列原理解释的是
| A.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 |
| B.增大压强可加快SO2转化为SO3的速率 |
| C.黄绿色的氯水光照后颜色变浅 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
羰基硫(COS)可作为一种蚜虫熏蒸剂,能防止某些昆虫、线虫和蚜虫的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.CO的平衡转化率为80% |
| D.反应前H2S物质的量为7mol |
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
| A.反应混合物的浓度 | B.反应体系的压强 | C.正、逆反应的速率 | D.反应物的转化率 |
在一定温度下,将气体和气体
各0.16
充入10
恒容密闭容器中,发生反应
+
 2
2
< 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| 2 |
4 |
7 |
9 |
|
| 0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
| A. |
反应前2 |
| B. |
其他条件不变,降低温度,反应达到新平衡前 |
| C. |
该温度下此反应的平衡常数 |
| D. |
其他条件不变,再充入0.2 |
将和
加入密闭容器中,在一定条件下发生反应:
。忽略固体体积,平衡时
的体积分数(%)随温度和压强的变化如下表所示。
| 压强/MPa 体积分数/% 温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
54.0 |
a |
b |
| 915 |
c |
75.0 |
d |
| 1000 |
e |
f |
83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的 ④
上述①~④中正确的有()
A.4个 B.3个 C.2个 D.1个
下列属于可逆反应的是
A.2SO2+O2 2SO3 2SO3 |
B.SO3+H2O=H2SO4 |
| C.HCl+NaOH=NaCl+H2O | D.2Na+2H2O=2NaOH+H2↑ |
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是( )
| A.达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20% |
| B.甲中NH3的体积分数与乙相等 |
| C.达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动 |
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol N2(g)+3H2(g);△H=+Q2KJ/mol |
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中再加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中再加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.第二次平衡时,Z的浓度为0.4 mol·L-1 |
| D.X与Y的平衡转化率之比为1:1 |
下列对各种平衡体系的叙述中,完全正确的一组是
① 在醋酸溶液中存在的电离平衡:CH3COOH CH3COO-+ H+,加水稀释后,溶液中所有离子浓度均减小
CH3COO-+ H+,加水稀释后,溶液中所有离子浓度均减小
② 常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动
③ 某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)  2Z(g) +W(s); △H>0平衡后,升高温度,该化学平衡正向移动
2Z(g) +W(s); △H>0平衡后,升高温度,该化学平衡正向移动
④在上述③的可逆反应中,当容器中气体压强不变时,反应达到平衡
⑤一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡
CH3COO-+ H2O CH3COOH + OH-使得溶液中的c (OH-)>c(H+)
CH3COOH + OH-使得溶液中的c (OH-)>c(H+)
⑥在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
| A.①②③④⑤ | B.②③④⑤⑥ | C.②③⑤⑥⑦ | D.①②⑤⑥⑦ |
试题篮
()