有某可逆反应aA(g)+bB(g) cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
| A.a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B.a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C.Q > 0时,y轴表示达到平衡时B的转化率 |
| D.Q < 0时,y轴表示达到平衡时A的浓度 |
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。

在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡
移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡状态所需时间/min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| II |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率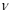 (CO)= ;
(CO)= ;
③实验II条件下反应的平衡常数K= (保留小数点后二位);H2O(g)的平衡转化率为 。
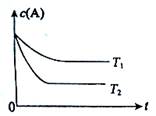
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向 方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是 。
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
对于反应
,在其他条件不变的情况下
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 |
| C. | 升高温度,反应速率加快,反应放出的热量不变 |
| D. | 若在原电池中进行,反应放出的热量不变 |
节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨。甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2 CH3OH。请根据图示回答下列:
CH3OH。请根据图示回答下列:

(1)关于该反应的下列说法中,正确的是 (填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,净测得CO和CH3OH(g)的浓度随时间变化如(图1)所示。从反应开始到平衡,CO的平均反应速率v(CO)= ,该反应的平衡常数K= 。
(3)恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO)增大的有 。
A.升高温度 B.充入He气
C.再充入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量=_____g/mol。
(5)根据(图2),写出此反应的热化学方程式 。
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 |
x |
y |
| A |
MgSO4的质量(忽略体积) |
CO的转化率 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
温度 |
容器内混合气体的密度 |
一定条件下,通过下列反应可以制备特种陶瓷的原料,

。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标
随
变化趋势合理的是()

| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
||
| C |
平衡常数 |
|
| D |
某恒温密闭容器中,可逆反应(
)

+
(
)-
达到平衡。缩小容器体积,重新达到平衡时,
(
)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
| A. |
产物 |
| B. |
平衡时,单位时间内 |
| C. |
保持体积不变,向平衡体系中加入 |
| D. |
若开始时向容器中加入1 |
(9 分)碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用。
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世界上最薄却也是最坚硬的纳米材料,同时也是导电性最好的材料。下列物质在一定条件下能与它反应的是________(填字母)。
| A.氧气 | B.单质氟 | C.氢氧化钠溶液 | D.浓硝酸 |
(2)①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CO(g)+2H2(g)="==" CH3OH(g) ΔH=-91kJ·mol-1
则CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____________。
(3)工业中用乙苯为原料,采用催化脱氢的方法制取苯乙烯的反应方程式为:
C6H5-CH2CH3(g) C6H5-CH=CH2(g)+H2(g)△H1
C6H5-CH=CH2(g)+H2(g)△H1
向体积为VL 的密闭容器中充入a mol 乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:


①计算600℃温度下该反应的平衡常数 。
②分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(4)某科研组设计如图装置,模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O 和CO2转化为O2和燃料(C3H8O)。该装置工作时,a 电极的反应为 。
反应在容积为1.0
的密闭容器中进行,
的初始浓度为0.050
。温度
和
下
的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度,平衡常数
(
)
(
)。(填"大于"、"小于" 或"等于")
(2)若温度时,5
后反应达到平衡,
的转化率为70%,则:
①平衡时体系总的物质的量为。
②反应的平衡常数=。
③反应在0~5区间的平均反应速率
=。
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=" -92.6" kJ / mol。测得数据如下表:
2NH3(g) △H=" -92.6" kJ / mol。测得数据如下表:
下列叙述不正确的是
| A.容器②中反应开始时v(正)> v(逆) |
| B.容器①、②中反应达平衡时压强相等 |
| C.容器②中反应达平衡时,吸收的热量Q为9.26 kJ |
| D.若条件为“绝热恒容”,容器①中反应达平衡时n (NH3)< 0.6 mol |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于 p% | D.无法判断 |
Ⅰ.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________ mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
Ⅱ.(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A、CO2+H2O +2NaClO===Na2CO3+2HClO
B、CO2+H2O +NaClO===NaHCO3+HClO
C、CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D、CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E、Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F、CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
试题篮
()