可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
可逆反应在一定条件下达到化学平衡状态的标志是( )
| A.反应停止了 | B.正反应速率与逆反应速率均为零 |
| C.反应物与生成物浓度相等 | D.正反应速率与逆反应速率相等 |
在体积不变的密闭容器中发生的反应是CO(g)+H2O(g) CO2(g)+H2(g)下列情况中,能说明反应达到化学平衡状态的是
CO2(g)+H2(g)下列情况中,能说明反应达到化学平衡状态的是
| A.混合气体的密度不再改变 | B.混合气体的质量不再改变 |
| C.混合气体的物质的量不再改变 | D.混合气体中CO的体积分数不再改变 |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)  CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)  2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
下列哪种说法可以证明反应N2 +3H2 2NH3已达到平衡状态( )
2NH3已达到平衡状态( )
| A.1mol N≡N键断开的同时, 有6 mol H-N键生成 |
| B.1 mol N≡N键断开的同时, 有6 mol H-N键断开 |
| C.1 mol N≡N键生成的同时, 有3 mol H-H键生成 |
| D.1 mol N≡N键断开的同时, 有3 mol H-H键断开 |
对于平衡CO2(g) CO2(aq) ΔH=-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是 ( )
CO2(aq) ΔH=-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是 ( )
| A.升温增压 | B.降温减压 | C.升温减压 | D.降温增压 |
氨的催化氧化4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
| A.以O2浓度变化表示的反应速率为0.064 mol·(L·s)-1 |
| B.反应达到平衡状态时NH3的转化率为20% |
C.升高温度能使 减小 减小 |
| D.将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol·L-1 |
已知某可逆反应:
mA(g) + nB(g)  pC(g) ∆H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ∆H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
| A.T1 <T2 P1>P2 m+n<P Q<0 | B.T1>T2 P1<P2 m+n>P Q>0 |
| C.T1<T2 P1<P2 m+n<P Q>0 | D.T1>T2 P1<P2 m+n>P Q<0 |
在一密闭容器中充入1molNO2气体,建立如下平衡2NO2  N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
| A.a>b | B.b>a | C.a=b | D.无法比较 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。 向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐 加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )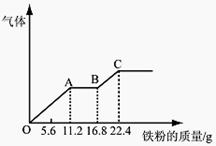
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
某温度下,反应SO2(g)+ 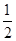 O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) + 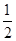 O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.0.02 | D.0.001 |
试题篮
()