欲配制1.00mol/L的NaCl溶液80mL,下列说法正确的是( )
| A.应选用100mL容量瓶 |
| B.配置之前容量瓶中残留的蒸馏水会导致浓度偏高 |
| C.定容时腐蚀刻度会导致浓度偏低 |
| D.摇匀、静置后发现凹液面低于刻度线,再加水至刻度线即可 |
下列对实验操作分析错误的是
| A.配制0.1mol/LNaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的量浓度偏低 |
| B.NH4NO3溶解吸热,若配制0.5mol/L NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则所得溶液的物质的量浓度偏高 |
| C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的量浓度偏高 |
| D.配制一定物质的量浓度溶液时,若定容中不小心加水超过刻度线,立刻将超出的水吸出,则所得溶液的物质的量浓度偏低 |
用NA表示阿伏加德罗常数的值。下列判断正确的是
| A.常温常压下,32 g O3含有的氧原子数目为2 NA |
| B.56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
| C.0.1 mol·L-1 Na2SO4溶液含有的钠离子数目为0.2 NA |
| D.标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA |
15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为
| A.4 mol·L—1 | B.3 mol·L—1 | C.2 mol·L—1 | D.1 mol·L—1 |
下列叙述中,正确的是
| A.标准状况下,Cl2的摩尔质量为71g |
| B.氧化还原反应一定有氧元素参加 |
| C.标准状况下,1molCCl4的体积是22.4L |
| D.Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
对标准状况下的四种气体的关系从小到大表示不正确的是
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3
| A.质量:④<①<③<② | B.密度:①<④<③<② |
| C.体积:④<①<②<③ | D.氢原子数:②<④<③<① |
明矾石是制取钾肥和氢氧化铝的重要原料。明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: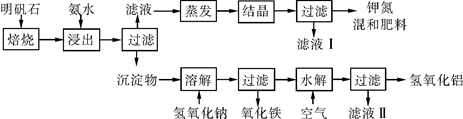
根据上述图示,完成下列填空。
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有250.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)写出沉淀物中所有物质的化学式:____________________。
(3)滤液Ⅰ的成分是水和________________________________。
(4)为测定混合肥料 K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
④若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为___________mol(用含m、n的代数式表示)。
环保检测中,有害气体的浓度常用1 L气体中有害气体的毫克值(mg·L -1 )来表示。如对某气体样品中所含CO的浓度进行测定,其方法和实验步骤如下:
①首先将2.00 L的气体样品通过盛有I 2 O 5 固体的加热管,反应后生成CO 2 和I 2 。
②用30.0 mL 5.00×10 -3 mol·L -1 的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
I 2 +2 S2O32- 2I - + S4O62-
2I - + S4O62-
③将②中溶液取出1/5,加入1.00 mL 1.00×10 -2 mol·L -1 的碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化。
(1)写出步骤①中CO通过I 2 O 5 加热管时有关反应的化学方程式。
(2)计算样品中CO的浓度。
配制一定物质的量浓度的某溶液,下列情况会使配制结果偏高的是
| A.定容摇匀后发现液面低于刻度线,再加水至刻度线 |
| B.容量瓶中原来含有少量蒸馏水 |
| C.未洗涤烧杯和玻璃棒 |
| D.定容时俯视刻度线观察液面 |
在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:

(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
下列各组实验中溶液最先变浑浊的是( )
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |
把3.9 g Na2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计)。
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A.在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L |
| B.5.6g铁与足量的氯气反应,转移电子数为0.2NA |
| C.11.2LH2O所含有的原子数为1.5NA |
| D.0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |
由乙醛和丁酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含碳的质量分数为( )
| A.6A%/7 | B.(1-A%)/7 | C.6(1-A%)/7 | D.(100-7A/6)% |
试题篮
()