(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g) pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。NO2和CO反应生成CO2和NO反应是放热反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持不变 |
| B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 |
| D.NO2的消耗速率与CO2的消耗速率相等 |
E.容器内气体的物质的量保持不变
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。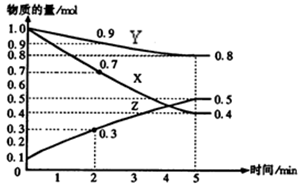
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至5minZ的平均反应速率为 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (大、小、相等)。
(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示。由图中数据分析,该反应的化学方程式为:_______________.
(2)反应开始至2 min,Z的平均反应速率为 。
(3)不同时间测得以下反应速率:
①v(X)=0.075 mol· L-1·min-1
②v(Y)=0.001 mol· L-1·s-1
③v(Z)=0.06 mol·L-1·min-1
速率由大到小关系正确为 。
A.①>③>② B.③>①>② C.②>③>①
某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了____ 状态。
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为 。
(2)合成氨厂可用反应CO(g)+H2O(g) H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1 mol、1 mol、2 mol、2 mol,此时该反应由 反应方向开始建立平衡。(选填“正”或“逆”)。
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为 。
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有___________;
a.增加CO的用量 b.增加H2O(g)的用量
c.增大压强 d.降低温度
(8分)698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) = 2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)容器的体积V=_____L
(2)反应达到最大限度的时间是_ _s,该时间内平均反应速率v(HI)= mol·L-1·s-1
(3)判断该反应达到平衡的依据是 (填序号)
①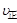 (I2)=2
(I2)=2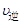 (HI)
(HI)
②H2、I2、HI的浓度都不变
③容器内气体的压强保持不变
④容器内气体的密度保持不变
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.Na2CO3溶液 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液
你认为可行的是 。
某学生为了探究足量的锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL,标况下) |
50 |
120 |
232 |
290 |
310 |
(1)假设用V1、V2、V3、V4、V5依次表示0~1、1~2、2~3、3~4、4~5每分钟内的反应速率,则速率由大到小的排列顺序为 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率V3= 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
(1)X的转化率是 ;
(2)由图中所给数据进行分析,该反应的化学方程为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(4)当反应进行到第 min,该反应达到平衡。
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题:
(1)该反应的化学方程式是 ;
(2)从开始至2min,NH3的平均反应速率是 ;
(3)用电子式表示X的形成过程___________________ __ __;
(4)第4分钟时下列叙述正确的是 ;
| A.该反应已停止 | B.该反应为可逆反应 |
| C.3v(H2)=2v(NH3) | D.c(H2):c(N2):c(NH3)=" 7" :9 :2 |
(5)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1mol N2与H2反应完全转化为NH3应_________热量(填“吸收”或“放出” )。
(10分)CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+1/2O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)= ,则CH3OH的转化率为 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是 。
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-==CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2 mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为_____________________。
某温度下,在2 L密闭容器中X、Y、Z三种气体进行反应, 其物质的量随时间的变化曲线如图。
(1)该反应的化学方程式是_____________________。
(2)若t1= 2min, 用X表示0-t1时间段的反应速率为 ___,X的转化率为 _________
(3)在t1 min时,该反应达到了化学平衡状态,下列可作为反应已达到平衡状态标志的是( )(填字母序号)
| A.X、Y、Z的反应速率相等 |
| B.生成3 mol Y的同时生成1 mol Z |
| C.生成1 mol Z的同时生成2 mol X |
| D.容器的压强保持一定 |
E.容器内气体的平均相对分子质量不再改变
试题篮
()