(10分)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: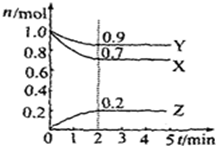
(1)该反应的化学方程式为__ ____.
(2)反应开始至2min,用X表示的平均反应速率为______ mol·L-1·min-1;
平衡时,Y的转化率为__ ____,
平衡时,Z的浓度为___ ___ mol·L-1。
(3)下列叙述能说明上述反应达到平衡状态的是_____ _(填选项、多选)
| A.X、Y、Z的物质的量之比为3:1:2 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.混合气体的总物质的量不随时间的变化而变化.
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1 。
将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g) 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6 mol,C的物质的量为0.4 mol,则:①用C表示该反应的速率为: ;
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6 mol,C的物质的量为0.4 mol,则:①用C表示该反应的速率为: ;
②用A表示的速率为: ;
③反应前A的物质的量浓度是: ;
④10s末,D的浓度为: ;
(1)反应A+3B 2C+2D在四种不同情况下的反应速率分别如下:
2C+2D在四种不同情况下的反应速率分别如下:
该反应进行的由快到慢顺序为 (填序号)
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如下图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号)_______________。
某温度时,在2L容器中X.、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,
(1)该反应的化学方程式为_ _
(2)反应开始至2min、Z的平均反应速率为_ _ 。
一定温度下,向容积为2L的密闭容器中通入3 molA和2mol B,混合气体起始压强为p0。发生如下反应:3A(g)+B(g) xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)X为 。
(2)反应在1min内,B的平均反应速率为 ;
(3)请用p0、p来表示2min时反应物B的转化率为 %。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是 ;
A.v(A)="0.5" mol·L-1·min-1
B.v(B)="0.2" mol·L-1·min-1
C.v(C)="0.3" mol·L-1·min-1
D.v(D)="0.5" mol·L-1·min-1
NaHSO3被用于棉织物及有机物的漂白以及在染料、造纸、制革等工业中用作还原剂。
(1)NaHSO3可由NaOH溶液吸收SO2制得。
2NaOH(aq) + SO2(g) = Na2SO3(aq) + H2O(l),△H1
2NaHSO3(aq) = Na2SO3(aq) + SO2(g)+ H2O(l),△H2
则反应SO2(g) + NaOH(aq) = NaHSO3(aq) 的△H3 = (用含△H1、△H2式子表示);且△H1 ______△H2(填“>”、“<”和“=”)。
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如下左图。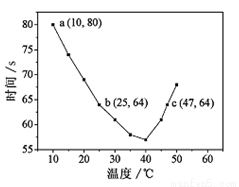
①a点时,v(NaHSO3)= mol·L-1·s-1。
②根据图中信息判断反应:I2 +淀粉 蓝色溶液的△H 0(填“>”、“<”或“=”)。
蓝色溶液的△H 0(填“>”、“<”或“=”)。
③10-40℃区间内,显色时间越来越短,其原因是 。
(3)已知:T℃时H2SO3的Ka1=1.5×10-2, Ka2=1.0×10-7;NaHSO3溶液pH<7。
在T℃时,往NaOH溶液中通入SO2。
①在NaHSO3溶液中加入少量下列物质后,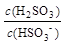 的值增大的是 。
的值增大的是 。
| A.H2O | B.稀H2SO4 | C.H2O2溶液 | D.NaOH溶液 |
②某时刻,测得溶液的pH=6,则此时,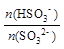 = 。
= 。
③请画出从开始通入SO2直至过量时,溶液中n(SO32-)∶n(HSO3-)随pH的变化趋势图 。
(17分)I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g)  2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________O(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)="a" mol/L,则c(HCN)=_________mol/L。
(1)氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示:
则该反应为 反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如下代数式表示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则根据该反应制取1mol H2要吸收或放出热量为 kJ(用含a b c d字母表示)。
(2)某温度下,10L密闭容器中充入1.8mol CH4和3mol H2O(g),发生CH4+2H2O(g)  CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
①前8s以H2O(g)表示的平均反应速率为 ;
②8s时,混合气体中H2的体积分数为 ;
将等物质的量的A、B混合于2L密闭容器中发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5, C的平均反应速率是0.1mol/(L.min)求:
(1)此时A的浓度为 ,反应开始前容器中B的物质的量为 。
(2)B的平均反应速率为 。
(3)x= 。
(1)某温度下,2 L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为___________________________________________________;
②0~10 s内,用Z表示的化学反应速率____________________________________;
③X的转化率为__________________;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2
(本题有2小题,共16分,每空2分)
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________。
②工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。
③工作时,电解质溶液中阴离子移向________极。
④电流方向从________极流向________极。
(2)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题:
①该反应的反应物是 。
②该反应的化学方程式为 。
③在0-2min,该反应用A表示的平均反应速率为 。
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)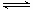 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) ________。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= ________mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_________。
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示:
(1)X的转化率是________;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=________;
(4)当反应进行到第________min,该反应达到平衡。
碳及其化合物在工农业生产生活中有着重要作用。请按要求回答下列问题:
(1)已知:C(s)+O2(g) = CO2(g) △H =" -393" kJ•mol-1;
2CO(g)+O2(g) = 2CO2(g) △H =" -566" kJ•mol-1;
2H2(g)+O2(g) = 2H2O(g) △H = -484 kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为______________________________________________________________________。
(2)将一定量CO(g)和H2O(g)分别通入容积为2 L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g)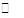 CO2(g)+H2(g),得到如下三组实验数据:
CO2(g)+H2(g),得到如下三组实验数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
500 |
4 |
8 |
3.2 |
4 |
| 2 |
750 |
2 |
4 |
0.8 |
3 |
| 3 |
750 |
2 |
4 |
0.8 |
1 |
①该反应的正反应为 (填“吸热”或“放热”)反应。
②实验1中,0~4 min时段内,以v(H2)表示的反应速率为 。若在此温度下H2O(g)、CO(g)起始量分别为2 mol、4 mol,则此反应的平衡常数为___________。
③实验2达到平衡时CO的转化率为 。
④实验3与实验2相比,改变的条件是 ;
请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号。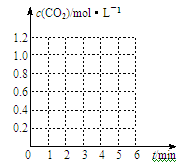
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为____________________________________。
(4)一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
______________________________________。
试题篮
()