A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol·Lˉ1。反应进行2min后A的浓度为0.8 mol·Lˉ1,B的浓度为0.6 mol·Lˉ1,C的浓度为0.6 mol·Lˉ1。则2min内反应的平均速率VA=__________,VB=_____________,VC=___________。该反应的化学反应方程式为___________________________。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
| 氢气体积(mL) |
50 |
120 |
224 |
392 |
472 |
502 |
(1) 哪一时间段(填0~1、1~2、2~3、3~4、4~5、5~6 min)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是 。
(3)第3 ~ 4分钟时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是 。
A.蒸馏水 B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: 实验测得不同温度下的平衡数据列于下表:
实验测得不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是 。
| A.2v(NH3)=v(C02) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
②根据表中数据,列式计算25.0℃时的分解平衡常数: 。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.O℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变AH O(填“>”、“=”或“<”),熵变AS O(填“>”、“=”或“<”)。
(2)已知:
 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
⑤25.O℃时,O~6 min氨基甲酸铵水解反应的平均速率: 。
⑥据图中信息,如何说明该水解反应速率随温度升高而增大: 。
某可逆反应在0—2分钟的进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的反应物是 ,生成物是 ,此反应 (填“是”或“不是”)可逆反应;反应开始至2分钟时, (填“能”或“不能”)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态,此时正反应速率 (填 “等于”或“不等于”) 逆反应速率。
(1)对于下列反应:2SO2 + O2  2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)右图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸: .
向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)  3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
(1)若t1="15" min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= 。
(2)t3时改变的条件为 ,
B的起始物质的量为 。
(3)t4~t5阶段,若A的物质的量减少了O.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: 。
(4)请在如图中定性画出工业合成NH3中H2的逆反应速率(V)随时间(t)变化关系的图像。(其相应的变化特点为:t1达到平衡,t2降温,t3又达到平衡,t4增大压强,t5再次达到平衡。)
控制变量法是研究化学变化规侓的重要思想方法。请仔细观察下表中50 mL稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
c(HCl) /mol·L-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
粒状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
粒状 |
0.6 |
20 |
41 |
280 |
| 4 |
粒状 |
0.8 |
20 |
40 |
200 |
| 5 |
粉末 |
0.8 |
20 |
40 |
30 |
| 6 |
粒状 |
1.0 |
20 |
40 |
120 |
| 7 |
粒状 |
1.0 |
30 |
50 |
40 |
| 8 |
粒状 |
1.2 |
20 |
40 |
90 |
| 9 |
粒状 |
1.2 |
25 |
45 |
40 |
分析并回答下列问题:
(1)本反应属于________反应(填“吸热”或“放热”),反应的离子方程式为 。
(2)实验6和7表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其它因素还有__________,能表明这一规律的实验序号是1、2与_______。
“碘钟”实验中,3I-+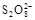 =I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/ mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(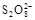 )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s~44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________________。
某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析求得:
(1)该反应的化学方程式为__________________________________。
(2)反应开始至4 min时,A的平均反应速率为________。
(3)4 min时,正、逆反应速率的大小关系为:v(正)________(填“>”、“<”或“=”,下同)v(逆),8 min时,v(正)________v(逆)。
在一密闭容器中充入1 mol H2和1 mol I2(g),压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)="==2HI(g)" ΔH<0。
(1)保持容器容积不变,向其中加入1 mol H2,反应速率________(填加快、不变或者减慢,下同),理由是_________________________。
(2)保持容器容积不变,向其中加入1 molHe,反应速率________,理由是__________________。
(3)保持容器内气体压强不变,向其中加入1 mol He,反应速率________,理由是__________。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率________,理由是________________________________。
(5)提高起始的反应温度,反应速率________,理由是________________________。
(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g) pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
(14分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是______。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
2HI H2+I2,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=__________。该温度下,H2(g)+I2(g)
H2+I2,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=__________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=______。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则______是原来的2倍。
2HI(g)的平衡常数K=______。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则______是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的______,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1。某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
大理石与盐酸反应的反应速率如右图所示,已知该反应为放热反应。
(1)写出该反应的离子反应方程式: 。
(2)反应开始时反应速率加快的原因是: 。
(3)反应后期反应速率下降的原因是: 。
T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正) v(逆)(填“>”“<”或“=”)。
(15分) I.工业上用CO生产燃料甲醇。一定条件下发生反应:co(g)+2H2(g) CH3OH(g)。下图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
CH3OH(g)。下图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
请回答下列问题。
(1)下列说法正确的是 (填字母序号)。
a.在甲图中,曲线b表示使用了催化剂
b.起始充入的CO为2mol,从反应开始到达到平衡,
c.增大CO的浓度,CO的转化率增大
d.容器中压强恒定时,说明反应已达平衡状态
e.保持温度和密闭容器的容积不变,再充入1mol CO和2mol H2,再次达到平衡时 的值会变小
的值会变小
(2)该温度下CO(g)+2H2 (g)  CH3OH(g)的化学平衡常数为 。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数 (填“增大”“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数 (填“增大”“减小”或“不变”)。
(3)请在丙图所示坐标图中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲
线,要求画出压强不同的两条曲线(在曲线上标出P1、P2且P1<P2)。
(4)已知CH3OH(g)+3/2 O2(g)="===" C02(g)+2H2O(g) △H=-192.9kJ/mol,又知H20(1)=====H2O(g)
△H= +44kJ/mol,请写出32g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式
II.已知:在25℃时,H20 H+ + OH — Kw=10-14;
H+ + OH — Kw=10-14;
CH3COOH H+ + CH3COO — Ka=1.8×10-5 。
H+ + CH3COO — Ka=1.8×10-5 。
(5)醋酸钠水解的平衡常数Kh的表达式为
(6)0.5mol·L-1醋酸钠溶液的pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液的pH为n,水解的程度为b。则a与b的关系为a b(填“大于”“小于”或“等于”)。
(7)0.9mol.L-1醋酸钠溶液中氢氧根离子的浓度为2.2×10-5mol·L-1 。在某溶液中含Mg2+、Cd2+ 、Zn2+ 三种离子的浓度均为0.01mol·L-1,向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,则能生成的沉淀化学式为
已知:Ksp[ Mg(OH)2 ]=1.8×10-11、Ksp[ Zn(OH)2 ]=1.2×10-17 、Ksp [ Cd(OH)2 ]="2.5" x 10-14 。
试题篮
()