常温下有五种溶液:①NaHCO3 ;②KNO3;③NH4HCO3;④KOH;⑤HCl
28.上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
上述①的水溶液呈碱性的原因是(用离子方程式表示) 。
29.取10mL 0.5mol/L⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.  ③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
30.②和④混合后撒入铝粉,有气体产生,该气体能使湿润的红色石蕊试纸变蓝。
写出该反应化学方程式:_______________________________________________________。
31.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。A.一定向正反应方向移动
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
32.如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化
B.通入大量稀有气体能提高反应的速率
C. (N2)/
(N2)/  (O2)=2:3
(O2)=2:3
D.容器中气体的密度不随时间而变化
33.若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为 。
一定温度下,向容积为2L的密闭容器中通入3 molA和2mol B,混合气体起始压强为p0。发生如下反应:3A(g)+B(g) xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)X为 。
(2)反应在1min内,B的平均反应速率为 ;
(3)请用p0、p来表示2min时反应物B的转化率为 %。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是 ;
A.v(A)="0.5" mol·L-1·min-1
B.v(B)="0.2" mol·L-1·min-1
C.v(C)="0.3" mol·L-1·min-1
D.v(D)="0.5" mol·L-1·min-1
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
(本小题满分14分)
T1温度下,体积为 2L的恒容密闭容器,加入4.00mol X,2.00mol Y,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。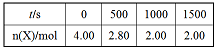
(1)前500s反应速率v(M)= _____________,该反应的平衡常数K=_____________。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________(填序号)
A.X的消耗速率与M的消耗速率相等
B.混合气体的平均相对分子质量不变
C.v(Y)与v(M)的比值不变
D.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____________。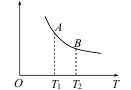
A.Y的逆反应速率
B.M的体积分数
C.混合气体的平均相对分子质量
D.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____________1.5mol/L(填“>”、“=”或“<”),理由是__________________。
(16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
工业上将煤气化过程中生成的CO和H2在一定条件下反应制得甲醇,反应的方程式为:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: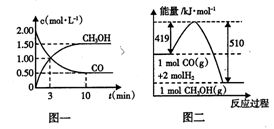
(1)从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2) =____ ;平衡时CO的转化率为____ 。
(2)该反应的平衡常数表达式为 ;若升高反应温度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
(3)若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,则到达平衡状态前该反应向____ (填“正”或“逆”)反应方向进行。
(4)根据图二,甲醇分解的热化学方程式为 。
(5)若以甲醇为原料制成燃料电池,在碱性介质中负极的电极反应式为____ 。
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
(1)某温度下,2 L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为___________________________________________________;
②0~10 s内,用Z表示的化学反应速率____________________________________;
③X的转化率为__________________;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2
Ⅰ、在容积为2.0 L的密闭容器内,物质D在 T ℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据上图写出该反应的化学方程式______________,该反应的平衡常数K=____________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(4)若在第7 min时增加D的物质的量,A的物质的量变化正确的是_______(用图中a、b、c的编号回答)。
Ⅱ、可逆反应①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
(5)达平衡(I)时体系的压强与反应开始时体系的压强之比为_____________
(6)达平衡(I)时,X的转化率为_______________
(7)X(g)+2Y(g) 2Z(g) 是_______热反应。
2Z(g) 是_______热反应。
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
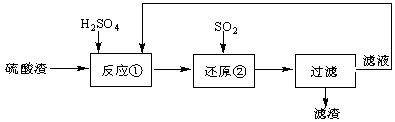
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
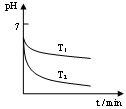
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
(本题有2小题,共16分,每空2分)
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________。
②工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。
③工作时,电解质溶液中阴离子移向________极。
④电流方向从________极流向________极。
(2)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题:
①该反应的反应物是 。
②该反应的化学方程式为 。
③在0-2min,该反应用A表示的平均反应速率为 。
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____ _____.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g) △H=___________;则该反应( )
| A.任何温度下都能进行 |
| B.任何温度下都不能进行 |
| C.高温下能自发进行 |
| D.低温下能自发进行 |
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol•L﹣1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正__________ v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=__________.
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)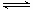 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) ________。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= ________mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_________。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = __________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________________________________________________________________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为___________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g)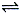 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) |
0 |
10 |
20 |
25 |
30 |
| 条件A [n(NO2)](mol) |
0.20 |
0.14 |
0.13 |
0.13 |
0.13 |
| 条件B [n(NO2)](mol) |
0.20 |
0.10 |
0.10 |
0.10 |
0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
试题篮
()