2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
(1)已知:① N2(g) + O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g) + O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g) +2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
下图是在101kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化的示意图。则a= 。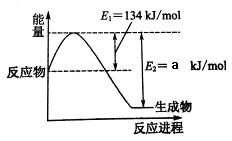
(2)将不同物质的量的H2O(g)和CO分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| 1 |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验组1中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、 1mol CO、 1 mol CO2和 x molH2,若要使反应在开始时正向进行,则x应满足的条件是 。
③若a=2,b=1,则达平衡时实验组2中H2O(g)和实验组3中CO的转化率的关系为α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向______移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为______。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________。下列不能说明该反应已达到平衡状态的是___________。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子质量不随时间变化而改变
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
② 0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数K1=_______。
N2O4(g)的平衡常数K1=_______。
③ 25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数K2_____K1(填“>”、“=”或“<”)。
N2O4(g)的平衡常数K2_____K1(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是______________ (用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.升高温度
C.缩小容器体积 D.加入一定量的N2O4
从图表中获得有用的信息是化学学习和研究的重要能力。
(1)图1是在一定条件下,反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)的实验曲线。
2CO(g)+2H2(g)的实验曲线。
①图中P1、P2、P3、P4代表不同压强,则压强大小的排列顺序为 。该反应的△H 0(选填“>”、“<”、“=”)。
②压强为 P4时,在 Y 点:υ(正) υ(逆)。(选填“>”、“<”、“=”);
③压强为P4时,密闭容器中CH4和CO2的起始浓度均为0.10mol•L-1,则1100℃时该反应的化学平衡常数
为 (保留三位有效数字)。
(2)温度与HCl压强对MgCl2·6H2O受热分解产物的影响如图所示,下列说法正确的是
| A.温度低于100℃,MgCl2·6H2O不会发生分解 |
| B.要得到MgO温度至少需要加热至600℃ |
| C.要得到无水MgCl2只要控制温度,不一定要在HCl气体中 |
| D.在HCl气体压强为0.25×106Pa时,温度由室温升高至300℃,发生的反应为MgCl2·6H2O=Mg(OH)Cl+HCl+5H2O |
(3)X-射线衍射可用于判断某晶态物质是否存在。Al-LiBH4是新型产氢复合材料,常温下可以与H2O反应生成H2。图3是含LiBH4为25%时Al-LiBH4复合材料的X-射线衍射图谱,图4是该复合材料在25℃(图谱a)和75℃(图谱b)时与水反应后残留固体物质的X-射线衍射图谱。据图分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是__ (填化学式),25℃和75℃时产物中不相同的物质是_ _ (填化学式)。

随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂3 mol H-H键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
(1)不同温度下水的离子积的数据:KW(25 ℃)=1×10-14;Kt1=a;Kt2=1×10-12,试回答以下问题:
①若25<t1<t2,则a________1×10-14(填“>”“<”或“=”),做此判断的理由是_______________________。
②25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=____________。
③在t2温度下测得某溶液pH=7,该溶液显__________(填“酸”“碱”或“中”)性。
(2)在一定温度下,有以下三种酸:
a.醋酸 b.硫酸 c.盐酸
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是______________(用a、b、c表示,下同)。
②当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为____________。反应所需时间的长短关系是____________。
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是____________。
(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示。由图中数据分析,该反应的化学方程式为:_______________.
(2)反应开始至2 min,Z的平均反应速率为 。
(3)不同时间测得以下反应速率:
①v(X)=0.075 mol· L-1·min-1
②v(Y)=0.001 mol· L-1·s-1
③v(Z)=0.06 mol·L-1·min-1
速率由大到小关系正确为 。
A.①>③>② B.③>①>② C.②>③>①
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。工业制硫酸的过程中,SO2催化氧化的原理:
2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
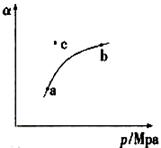
(1)某温度下,测得SO2(g)的平衡转化率(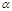 )与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
)与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
(8分)698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) = 2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)容器的体积V=_____L
(2)反应达到最大限度的时间是_ _s,该时间内平均反应速率v(HI)= mol·L-1·s-1
(3)判断该反应达到平衡的依据是 (填序号)
①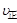 (I2)=2
(I2)=2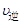 (HI)
(HI)
②H2、I2、HI的浓度都不变
③容器内气体的压强保持不变
④容器内气体的密度保持不变
对于反应:CO(g)+H2O(g)  CO2(g)+H2 (g) ΔH>0请回答下列问题:
CO2(g)+H2 (g) ΔH>0请回答下列问题:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则 0~4min内的平均反应速率v(CO)=______ mol/(L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
则:
①C1数值___(选填“>”、“<”或“=”)0.08 mol/L。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选);表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol 反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol 反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是 (填字母序号)。
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率 反应②的反应速率(填“>”、“<”或“=”),理由是 ;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是 ;
研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g)⇌CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) ⇌CH3OH (g)+H2(g)的△H= kJ·mol-1。
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。
(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:
①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
(10分)(1)恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题: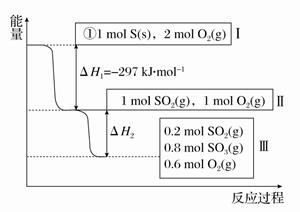
①写出能表示硫的燃烧热的热化学方程式: ___________________。
②ΔH2=________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250℃,是因为此条件下,原料气转化率最高
试题篮
()