一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH溶液 ②H2O ③CH3COONa固体 ④NaNO3溶液⑤稀硫酸
| A.②③ | B.②④ | C.②③④ | D.①②③④⑤ |
下列说法不正确的是
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.增大反应物浓度,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓+ H2O,下列各组实验中最先出现浑浊的是
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
下列有关活化分子和活化能的说法不正确的是
| A.增加气体反应物的浓度可以提高活化分子百分数 |
| B.升高温度可增加单位体积活化分子数 |
| C.发生有效碰撞的分子一定是活化分子 |
| D.使用催化剂可降低活化能,提高单位体积活化分子百分数 |
为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象: ,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
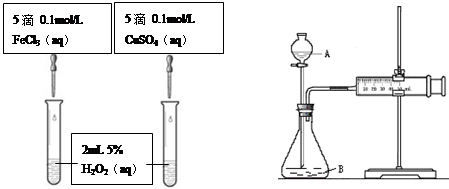
图一 图二
(2)检查图二装置气密性的方法是 。图二所示实验中需测量的数据是 。
少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑧ | C.③⑦⑧ | D.⑦⑧ |
NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的
| A.使用催化剂并不能改变反应速率 | B.使用催化剂可以加快反应速率 |
| C.降低压强能加快反应速率 | D.降温可以加快反应速率 |
为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。

(1)图一可通过观察① 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是② ,你认为还可以作何改进?③ 。
(2)图二可用于定量比较反应的快慢,检查图二装置气密性的方法是 。利用图二做实验时需测量的数据是 。
反应 A+B→C 的反应速率方程式为:v=k c (A) c (B),v为反应速率,k为速率常数。当c (A)=c (B)=1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
下列说法正确的是
| A.活化分子间所发生的碰撞为有效碰撞 |
| B.增大反应物浓度,可增大活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子百分数 |
| D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
下列说法正确的是( )
| A.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.增大压强会加快化学反应速率,其原因是增加了活化分子的百分率 |
| D.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
将等质量的A、B两份过量的锌粉装入试管中,分别加入浓度和体积均相同的稀硫酸,同时向装A的试管中加入少量CuSO4溶液。如图表示产生氢气的体积V与时间t的关系,其中正确
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
6 |
0.2 |
5 |
0.2 |
9 |
| C |
35 |
8 |
0.15 |
10 |
0.1 |
2 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
升高温度时,化学反应速率加快,主要原因是
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.活化能降低,活化分子百分数增加 |
试题篮
()