设C+CO2 2CO DH>0 ,反应速率为V1;N2+3H2
2CO DH>0 ,反应速率为V1;N2+3H2 2NH3 DH<0,反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
2NH3 DH<0,反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
| A.同时增大 | B.同时减少 |
| C.V1增大,V2减小 | D.V1减小,V2增大 |
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是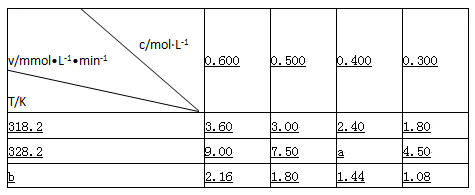
| A.a=6.00 |
| B.同时改变反应温度和蔗糖的浓度,v可能不变 |
| C.b<318.2 |
| D.不同温度时,蔗糖浓度减少一半所需的时间相同 |
500 mL 1 mol/L的稀HCl与锌粒反应,不会使反应速率加快的是
| A.升高温度 |
| B.将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl |
| C.用1 mol/L的H2SO4代替1 mol/L的HCl |
| D.用锌粉代替锌粒 |
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加NaCl溶液 ⑤改用10mL 0.1mol/L的盐酸⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
| A.①⑥⑦ | B.③⑤⑦ |
| C.①④⑦ | D.③⑥⑦ |
已知,H2和I2反应的历程为:①I2+M 2I·+M慢 ②H2+2I·→2HI快,式中M是指反应器壁或其他惰性分子,不参与反应,只具有传递能量的作用。下列关于该反应的说法正确的是
2I·+M慢 ②H2+2I·→2HI快,式中M是指反应器壁或其他惰性分子,不参与反应,只具有传递能量的作用。下列关于该反应的说法正确的是
| A.反应速率与I·的浓度有关 |
| B.M是该反应的催化剂 |
| C.反应①与②的活化能相等 |
| D.v(H2)=v(I2)=v(HI) |
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.⑤⑦⑧ |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器的容积 | C.移去部分SO3 | D.降低体系温度 |
其他条件不变时,下列说法正确的是
| A.升高温度,活化分子百分数增加,化学反应速率增大 |
| B.增大压强,活化分子百分数增加,化学反应速率增大 |
| C.加入反应物,活化分子百分数增加,化学反应速率增大 |
| D.活化分子间所发生的碰撞均为有效碰撞 |
对于反应M+N=P,如果温度升高10℃,反应速率增加为原来的3倍,在10℃时完成反应的10%,需要54min,将温度升高至40℃,完成反应的10%,需要的时间为( )
| A.2min | B.3min | C.6min | D.9min |
一定质量的Zn片与足量盐酸反应,欲使反应速率增大,产生的H2质量不变,可采取下列哪些措施()
| A.增加Zn片质量 | B.增加盐酸的体积 |
| C.滴加几滴CuSO4溶液 | D.升高温度 |
下列说法正确的是( )
| A.对于有气体参与的反应,增大压强,活化分子数增多,化学反应速率增大 |
| B.对放热反应而言,升高温度,活化分子百分数减少,反应速率减小 |
| C.活化分子间发生的碰撞为有效碰撞 |
| D.使用催化剂,活化分子百分数增多,化学反应速率增大 |
在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )

| A.该反应的热化学方程式:N2+3H2 = 2NH3 ΔH=-92 kJ/mol |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应放出的热量增多 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
| A.①②④ | B.②③④ | C.①③④ | D.①②③ |
试题篮
()