升高温度时,化学反应速率加快,主要原因是
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.活化能降低,活化分子百分数增加 |
一定条件下的密闭容器中,进行如下反应:NO(g)+CO(g)  1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
| A.加(正)催化剂 | B.增大压强(体积减小) |
| C.给体系加热 | D.从体系中不断移去部分CO2 |
将下列四组溶液在烧杯中分别同时迅速混合,此时,硫代硫酸钠和盐酸缓慢地进行反应,则出现浑浊的先后顺序是( )
① 20℃ 10mL 5.4mol/L的Na2S2O3溶液和20mL 1.5mol/L盐酸 ② 20℃ 10mL 4.0mol/L的Na2S2O3溶液和10mL 2.0mol/L盐酸③ 30℃ 15mL 3.5mol/L的Na2S2O3溶液和10mL 2.5mol/L盐酸 ④ 30℃ 20mL 3.0mol/L的Na2S2O3溶液和10mL 3.0mol/L盐酸
| A.③④②① | B.①②③④ | C.④③②① | D.④①③② |
对于合成氨N2(g)+3H2(g)  2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
| A.升高温度,对正反应的反应速率影响更大 |
| B.增大压强,对正反应的反应速率影响更大 |
| C.减小反应物浓度,对逆反应的反应速率影响更大 |
| D.加入催化剂,对逆反应的反应速率影响更大 |
用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.改用98%的浓硫酸 |
| C.改用锌粒 | D.滴加少量CuSO4溶液 |
下列说法不正确的是
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.加入反应物,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
在恒容条件下,能使NO2(g)+CO(g)  CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
| A.增大NO2或CO的浓度 | B.减小CO2或NO的浓度 |
| C.通入Ne使气体的压强增大 | D.升高反应的温度 |
在恒温恒容条件下,能使A(g) + 2B(g)  C(g) +D (g) 正反应速率增大的措施是
C(g) +D (g) 正反应速率增大的措施是
| A.增大A的浓度 | B.减小C的浓度 |
| C.减小B的浓度 | D.减小压强 |
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
| A.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快 |
| C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 |
| D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同 |
已知反应A2(g)+2B(s) A2B2(g) △H<0,下列说法正确的是( )
A2B2(g) △H<0,下列说法正确的是( )
| A.升高温度,化学平衡向正反应方向移动 |
| B.增大压强,正反应与逆反应速率均增大 |
| C.增大压强,化学平衡向正反应方向移动 |
| D.增大B的物质的量,化学平衡向正反应方向移动 |
下列说法正确的是
| A.增大压强,活化分子百分数增多,化学反应速率一定增大 |
| B.升高温度,活化分子百分数不变,化学反应速率一定增大 |
| C.加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 |
| B.加入少量水,v(H2)减小,生成H2量减少 |
| C.加入CH3COONa固体,v(H2)减小,生成H2量不变 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )
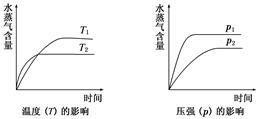
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)ΔH<0 CO(NH2)2(s)+H2O(g)ΔH<0 |
B.CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0 CO(g)+H2O(g)ΔH>0 |
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g)ΔH>0 CH2===CH2(g)+H2O(g)ΔH>0 |
| D.2C6H5CH2CH3(g)+O2(g)===2C6H5CH===CH2(g)+2H2O (g)ΔH<0 |
用纯净的CaCO3与稀盐酸反应制取CO2,实验过程记录如图所示。根据分析、判断,正确的是 
| A.OE段表示反应速率最快 |
| B.EF段表示反应速率最快,单位时间内收集的CO2最多 |
| C.FG段表示收集的CO2最多 |
| D.OG段表示随着时间的推移,反应速率逐渐增快 |
下列图示与对应的叙述相符的是
| A.图①可以表示对某化学平衡体系改变温度后反应速率的变化 |
| B.图②中由于Mg比Al活泼,所以Mg为负极 |
| C.图③可以表示向明矾溶液中滴加氢氧化钠溶液产生沉淀量的变化 |
| D.图④可以表示足量锌粉与稀硫酸反应,加少量CuSO4固体产生H2的变化 |
试题篮
()