在理论上不能用于设计原电池的化学反应是
| A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s) △H<0 |
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2O(l) △H<0 2CO2(g)+3H2O(l) △H<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0 |
| D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) △H<0 |
下列说法正确的是
| A.强电解质一定易溶于水 |
| B.钢铁在海水中发生电化腐蚀时,铁是负极被氧化 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
下列设备工作时,将化学能转化为电能的是( )
| A |
B |
C |
D |
 |
 |
 |
 |
| 硅太阳能电池 |
锂离子电池 |
太阳能集热器 |
燃气灶 |
下列反应能设计成原电池提供电能的是
| A.Cu与Cl2燃烧反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 | D.氢氧化钠溶液与稀盐酸反应 |
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )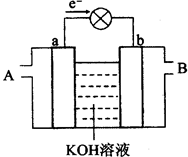
| A.A处通入空气,B处通入水煤气 |
| B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C.a电极发生还原反应,b电极发生氧化反应 |
| D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L |
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,
0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| |
实验步骤 |
实验现象及相关结论 |
| ① |
取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ② |
继续加入 溶液,再加入 溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4。 |
| ③ |
另取少量电解质溶液于试管中,先加 1 mol·L-1的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡。 |
; 。 |
(5)若电池开始工作时每100mL电解质溶液含KOH56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度 。 (结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
有关下图的说法正确的是
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.上图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O |
某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是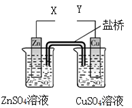
| A.X和Y与电流表连接,电子由Cu极流向Zn极 |
| B.X和Y与电流表连接,将Zn换成Fe测得电流更大 |
| C.X和Y分别与电源“—”、“+”极相连,Cu极质量减轻 |
| D.X和Y分别与电源“—”、“+”极相连,Zn极质量减轻 |
控制适当的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是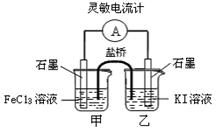
| A.反应开始时,乙中电极反应为2I--2e-= I2 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.平衡时甲中溶入FeCl2固体后,电流计读数为零 |
试题篮
()