在理论上可用于设计原电池的化学反应是
| A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(aq)+3H2(g);△H <O |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0 |
| C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0 |
D.FeCl3(aq)十3H2O(1) Fe(OH)3(s)+3HCl(aq);△H >0 Fe(OH)3(s)+3HCl(aq);△H >0 |
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为( )
A、 A是Zn,B是Cu,C是稀H2SO4
B、 A是Cu,B是Zn,C是稀H2SO4
C、 A是Fe,B是Ag,C是稀AgNO3溶液
D、 A是Ag,B是Fe,C是稀AgNO3溶液
如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,电流表指针发生偏转,以下表述不正确的是
A.甲池发生了原电池反应
B.Mg是正极
C.乙烧杯中可以用乙醇代替氢氧化钠溶液,电流表仍会偏转
D.甲池pH逐渐减小
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH﹣﹣2e﹣=ZnO+H2O;Ag2O+H2O+2e﹣=2Ag+2OH﹣
根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag20极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
下列各组材料中,不能组成原电池的是 ( )
| |
A |
B |
C |
D |
| 两极材料 |
Zn片、石墨 |
Cu片、Ag片 |
Zn片、Cu片 |
Fe片、Cu片 |
| 插入溶液 |
硫酸溶液 |
硝酸银溶液 |
蔗糖溶液 |
稀盐酸 |
关于锌、铜和稀H2SO4构成的原电池的下列说法中正确的是
| A.锌溶解的速率比锌直接与同浓度硫酸反应快 |
| B.电子从铜片经导线流向锌片 |
| C.负极的反应式为2H++2e-===H2↑ |
| D.反应一段时间后,溶液的pH降低 |
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.不使电池中渗泻的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |
铜锌原电池(如图)工作时,下列叙述正确的是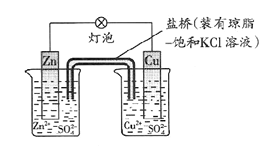
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列关于电化学的理解正确的是
| A.原电池一定是负极材料失电子,发生氧化反应 |
| B.电解池的电极材料一定不参与电极反应 |
| C.原电池的负极和电解池的阳极一定发生氧化反应 |
| D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是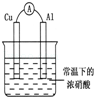
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC工作原理如图所示,下列有关说法正确的是
A.当有0.1mol电子转移时,a电极产生2.24LH2
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B池中的H+可以通过隔膜进入A 池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
下列关于铁电极的说法中,正确的是
| A.钢铁的吸氧腐蚀中铁是正极 | B.在铁片上镀铜时铁片作阳极 |
| C.电解饱和食盐水时可用铁作阴极 | D.镀锌铁板发生电化学腐蚀时铁是负极 |
右图是研究铁钉腐蚀的装置图,下列说法不正确的是
| A.铁钉在两处的腐蚀速率:a < b |
| B.a、b两处铁钉中碳均正极 |
| C.a、b两处铁钉中的铁均失电子被氧化 |
| D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O |
试题篮
()