将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速度甲比乙慢 |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是


| A. |
该电池能够在高温下工作 |
| B. |
电池的负极反应为: |
| C. |
放电过程中, |
| D. |
在电池反应中,每消耗1 |

2Cu + Ag2O ==Cu2O + 2 Ag,下列有关说法正确的是
| A.普通水泥的主要成分为2CaO·SiO2,32CaO·SiO2,3CaO·Al2O3, |
| B.测量原理示意图中,Ag2O为负极 |
| C.负极的电极反应式为:2Cu + 2OH——2e—==Cu2O + H2O |
| D.电池工作时,OH—向正极移动 |
错误的是
| A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+ |
| B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
现有甲、乙、丙、丁四种金属,为了判断其活泼性强弱,某同学设计了下列实验:
①甲、乙在氢氧化钠溶液中构成原电池,根据气泡产生的电极,确定甲、乙活泼性
②将等物质的量的丙、丁放入稀硫酸中,比较产生氢气的量,比较丙、丁活泼性
③用石墨为电极,电解等物质的量浓度的乙、丁的硫酸盐溶液,根据阴极先析出金属判断乙、丁活泼性
④将甲单质投入丙的盐溶液中,根据是否置换丙单质判断甲、丙的活泼性
上述实验能达到目的的是 ( )
| A.①④ | B.②③ | C.③ | D.④ |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和O2,其中一极的电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O,有关此电池的错误的推断是
| A.通O2的电极为负极 |
| B.参加反应的O2与C2H6的物质的量比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.电解质溶液中,CO32-向正极移动 |
关于右图所示的原电池,下列说法正确的是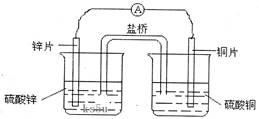
| A.电子从锌电极通过检流计流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.锌电极发生还原反应,铜电极发生氧化反应 |
| D.铜电极上发生的电极反应是2H++e-→H2↑ |
用铜片、银片、Cu(NO3) 2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型 管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是( )
管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是( )
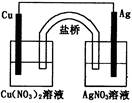

①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag+ + e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-→PbSO4+2e
正极:PbO2+4H+SO42-+2e→PbSO4+2H2O
今若制得Cl20.50mol,这时电池内消耗的H2SO4的物质的量至少是
| A.0.025mol |
| B.0.050mol |
| C.0.10mol |
| D.0.20mol |
某蓄电池充放电时的反应如下:
有下列推断,其中正确的是:①放电时铁极为正极,Ni2O3为负极 ②充电时阴极上的电极反应式是Fe(OH)2+2e=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④蓄电池的电极必须浸在某种碱性电解质溶液中
| A.②③④ |
| B.①③④ |
| C.①②④ |
| D.①②③ |
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充
电时发生的化学反应可用下式表示:Pb+PbO2+2H2SO4 2PbSO4+2H2O据此判断下列叙述
2PbSO4+2H2O据此判断下列叙述
正确的是
A.放电时负极电极反应式为:PbO2+4H+ + SO42-+2e- PbSO4+2H2O PbSO4+2H2O |
B.充电时阴极电极反应式为:PbSO4+2e- Pb+SO42- Pb+SO42- |
| C.充电时,若要使1molPbSO4转变为Pb和PbO2,则需要通过2mol电子 |
| D.放电时,H+向负极移动 |
下列说法正确的是( )
| A.原电池是把电能转化为化学能的装置 |
| B.原电池中电子流出的一极是正极 |
| C.原电池的两极发生的反应均为氧化还原反应 |
| D.形成原电池后,原电池中的阳离子移向正极 |
试题篮
()