如下图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( ) 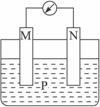
| |
M |
N |
P |
| A |
锌 |
铜 |
稀硫酸溶液 |
| B |
铜 |
铁 |
稀盐酸 |
| C |
银 |
锌 |
硝酸银溶液 |
| D |
锌 |
铁 |
硝酸铁溶液 |
铅蓄电池是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2
 2PbSO4+2H2O,则下列说法正确的是( )
2PbSO4+2H2O,则下列说法正确的是( ) 
| A.放电时,电流方向由B过M到A |
| B.充电时,铅蓄电池的正极应与充电器电源的负极相连 |
C.放电时,正极反应是Pb-2e-+ ====PbSO4 ====PbSO4 |
D.充电时,阳极反应是PbSO4-2e-+2H2O====PbO2+ +4H+ +4H+ |
用两根铂丝做电极插入KOH溶液中,再向两个电极上分别通甲烷气和氧气可形成原电池——燃料电池,根据两极反应的实质判断,
的一极,在下列叙述中正确的是
| A.阴极:4H2O+2O2+8e=8OH- |
| B.正极:4H2O+2O2+8e=8OH- |
| C.阴极:4OH--4e=2H2O+O2↑ |
| D.正极:4OH--4e=2H2O+O2↑ |
下列叙述不正确的是( )
| A.锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 |
| B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
| C.钢铁表面常易被锈蚀生成Fe2O3·nH2O |
| D.钢铁在发生析氢腐蚀和吸氧腐蚀时,电极反应相同的是负极反应 |
在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的 离子浓度逐渐增大 离子浓度逐渐增大 |
B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )

| A. |
|
B. |
|
| C. |
|
D. |
|
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为溶液,下列有关该电池的叙述不正确的是()
| A. |
正极反应式为:
|
| B. |
工作一段时间后,电解液中
|
| C. |
该燃料电池的总反应方程式为:
|
| D. |
用该电池电解
|
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应式为:负极:2H2-4e-+2OH- 4H2O正极:O2+4e-+2H2O
4H2O正极:O2+4e-+2H2O 4OH所产生的水还可作为饮用水,今欲得常温下1L水,则电池内电子转移的物质的量约为( )
4OH所产生的水还可作为饮用水,今欲得常温下1L水,则电池内电子转移的物质的量约为( )
| A.8.9×10-3 mol | B.4.5×10-2 mol |
| C.1.1×102 mol | D.5.6×10 mol |
试题篮
()