下列说法中正确的是
| A.原电池是把电能转变为化学能的装置 |
| B.原电池中电子流出的一极是负极,发生氧化反应 |
| C.原电池的两极发生的反应均为氧化还原反应 |
| D.形成原电池后,原电池中的阳离子向负极方向移动 |
某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是
| A.铁 | B.铜 | C.铝 | D.镁 |
下图为水果电池的示意图,下列说法正确的是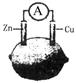
| A.锌片作负极,质量逐渐减少 | B.电子由铜片沿导线流向锌片 |
| C.铜电极逐渐溶解 | D.该装置能将电能转化为化学能 |
铜锌原电池(如下图)工作时,下列叙述正确的是 ( )
| A.正极反应为:Zn—2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2+ +Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
下列各组材料中,不能组成原电池的是( )
| |
A |
B |
C |
D |
| 两极材料 |
锌片、石墨 |
铜片、银片 |
锌片、铜片 |
铁片、铜片 |
| 插入溶液 |
稀硫酸 |
硝酸银溶液 |
蔗糖溶液 |
稀盐酸 |
在500 mL KNO3和Cu(NO3)2的混合溶液中c(NO- 3)="6" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中 c(K+)为2 mol•L-1 | B.上述电解过程中转移电子总数为2 NA |
| C.电解得到的Cu的物质的量为0.5 mol | D.电解后溶液中c(H+)为2 mol·L-1 |
锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( )
①锌极有气泡产生 ②电子由Zn经外电路流向Cu
③负极:Zn +2e-=Zn2+ ④Cu2+在溶液中由Cu棒向Zn棒迁移
| A.①②④ | B.②③ | C.② | D.②④ |
下列说法正确的是
| A.牺牲阴极的阳极保护法是应用电解原理防止金属的腐蚀 |
| B.CO的标准燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+566.0 kJ·mol-1 |
| C.一个反应能否自发进行取决于该反应是放热还是吸热 |
| D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 mol,则阴极上析出Cu的质量为
| A.0.64 g | B.5.12 g | C.2.56 g | D.1.28 g |
如图把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。某实验兴趣小组做完实验后,在读书卡上的记录如下所示,则卡片上的描述合理的是( )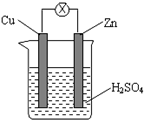
卡片号:2013.4
实验后的记录:
①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生
③SO42-向Cu极移动 ④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子流向是:Cu  Zn
Zn
⑥正极反应式:Cu + 2e- = Cu2+
| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
""蓄电池的结构如图所示,电极材料多孔
和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )

| A. |
电池反应中有
|
| B. | 电池的总反应是金属钠还原三价铝离子 |
| C. |
正极反应为:
|
| D. | 钠离子通过钠离子导体在两电极间移动 |
在理论上不能用于设计原电池的化学反应是 ( )
| A.HCl ( aq ) + NaOH ( aq ) =" NaCl" ( aq ) + H2O ( l ) △H < 0 |
| B.2CH3OH ( l ) +3O2 ( g ) = 2CO2 ( g ) + 4H2O ( l )△H < 0 |
| C.4Fe (OH)2 ( s ) + 2H2O ( l ) + O2 ( g ) =" 4Fe" (OH)3( s )△H < 0 |
| D.2H2 ( g ) + O2 ( g ) = 2H2O ( l )△H < 0 |
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,
0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| |
实验步骤 |
实验现象及相关结论 |
| ① |
取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ② |
继续加入 溶液,再加入 溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4。 |
| ③ |
另取少量电解质溶液于试管中,先加 1 mol·L-1的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡。 |
; 。 |
(5)若电池开始工作时每100mL电解质溶液含KOH56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度 。 (结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
试题篮
()