由铜、锌、稀硫酸组成的原电池中,下列说法错误的是( )
| A.锌是负极,其质量逐渐减少 |
| B.氢离子在铜表面被还原,产生气泡 |
| C.电流从锌片经导线流向铜片 |
| D.电子从锌片经导线流向铜片 |
对于右图所示的锌、铜和稀硫酸组成的原电池,下列说法正确的是
| A.负极的反应式为2H++2e-==H2↑ |
| B.电流由Zn经外电路流向Cu |
| C.反应一段时间后,溶液中的c(H+)减小 |
| D.溶液中H+向负极移动 |
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化) ( )
| A.杠杆为导体或绝缘体时,均为A端高B端低 |
| B.杠杆为导体或绝缘体时,均为A端低B端高 |
| C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低 |
| D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
下列反应不可用于设计原电池的是
| A.NaOH+HCl = NaCl+H2O |
B.2CH3OH+3O2 2CO2+4H2O 2CO2+4H2O |
| C.Zn+2HCl = ZnCl2+H2↑ |
| D.4Al+3O2+6H2O = 4Al(OH)3 |
镍氢电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
| A.NiO(OH) | B.Ni(OH)2 | C.H2 | D.H2和NiO(OH) |
下列叙述不正确的是
| A.原电池是将化学能转化为电能的装置 |
| B.铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C.钢铁腐蚀的正极反应:Fe-3e-=Fe3+ |
| D.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑ |
下图是课外活动小组设计的用化学电源使LED灯发光的装置。 下列说法错误的是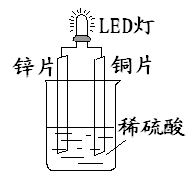
| A.铜片表面有气泡生成 |
| B.装置中存在“化学能→ 电能→ 光能”的转换 |
| C.如果将硫酸换成柠檬汁,导线中不会有电子流动 |
| D.如果将锌片换成铁片,电路中的电流方向不变 |
根据下图,判断下列说法中错误的是( )
| A.导线上电子由Ag极流向石墨极 |
| B.负极电极反应式:Fe3+ + e-=Fe2+ |
| C.盐桥中阴离子移向AgNO3溶液 |
| D.总反应为:Fe3+ + Ag=Fe2+ + Ag+ |
将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.上图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O |
有关下图的说法正确的是
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )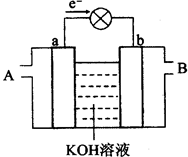
| A.A处通入空气,B处通入水煤气 |
| B.a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C.a电极发生还原反应,b电极发生氧化反应 |
| D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24 L |
试题篮
()