本题为《化学反应原理(选修4)》模块选做题,每空2分,共20分。
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量。则表示H2燃烧热的热化学方程式是( )
A.H2(g) +1/2 O2(g)=H2O(g) ΔH =+285.8 kJ/mol
B.H2(g) +1/2 O2(g)=H2O(l) ΔH =-285.8 kJ/mol
C.H2(g) +1/2 O2(g)=H2O(l) ΔH =+285.8 kJ/mol
D.H2 +1/2 O2 =H2O ΔH =-285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是 (填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
反应达到平衡后,升高温度则反应速率 (填“增大”或“减小”);平衡将向 (填“正反应方向”或“逆反应方向”)移动。
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C Zn+CO↑,此法属 (填选项字母代号)。
Zn+CO↑,此法属 (填选项字母代号)。
A.电解法 B.热还原法 C.热分解法
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液 (B)0.1mol/LNH4Cl溶液
①溶液(A)的pH 7(填“>”、“<”或“=”);
②溶液(B)呈 性(填“酸”、“碱”或“中”),升高温度可以 (填“促进”或“抑制”)NH4Cl的水解。
发生在天津港“8·12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注。
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为: 。
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(4)电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为 。

(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。已知在常温下:Ksp[Fe(OH)2]= 1×10-15、Ksp[Fe(OH)3]= 1×10-38、Ksp[Cr(OH)3]= 1×10-23,当离子浓度在1×10-5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10. 0mol/L Cr3+同时生成沉淀的pH范围是 。
关于下列装置说法正确的是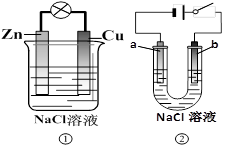
| A.装置①中的铜棒上冒气泡 |
| B.若a、b极是石墨,装置②中的a、b 冒气泡 |
| C.装置①换上硫酸铜溶液,将实现锌片上镀铜 |
| D.装置②换上硫酸铜溶液,将实现“b极”镀铜 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧 化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是 ( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH- (aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
| A.O2在电极b上发生还原反应 |
| B.溶液中OH—向电极a移动 |
| C.反应消耗的NH3与O2的物质的量之比为4:5 |
| D.负极的电极反应式为:2NH3-6e—+6OH—=N2+6H2O |
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
关于下列各装置图的叙述中,不正确的是
| A.①中总反应为Zn + CuSO4 ="Cu" + ZnSO4 |
| B.②中正极反应为2H2O + O2 + 4e-=4OH- |
| C.③中负极反应为Zn+2OH-- 2e-=Zn(OH)2 |
| D.④中向Fe电极区滴入2滴铁氰化钾溶液产生蓝色沉淀 |
科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸汽,其中电池的电解质是掺杂了Y2O3(Y为钇)的ZrO2 (Zr为为锆)晶体,它在高温下能传导O2—离子。若以丁烷(C4H10)代表汽油,总反应为2 C4H10+13O2=8CO2+10H2O。有关该电池说法错误的是
| A.该电池负极的电极反应式为:2C4H10+26O2—-52e— = 8CO2+10H2O |
| B.该电池正极的电极反应式为:O2+ 4e—+ 2H2O= 4OH— |
| C.O2—向负极移动 |
| D.丁烷在放电时发生氧化反应 |
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu  Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。
③有下述装置(如下图),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
某兴趣小组设计如图微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列有关描述正确的是
| A.断开K2,闭合K1时,铜电极为阳极 |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极发生还原反应 |
| D.断开K1,闭合K2时,石墨电极作正极 |
已知反应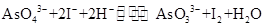 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 、
、 均为石墨电极),分别进行下述操作。
均为石墨电极),分别进行下述操作。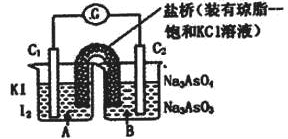
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O |
| D.Ⅱ操作过程中,C1棒上发生的反应为:2I――2e-=I2 |
下列有关实验现象的描述中,正确的是
| A.上图所示装置中,锌电极上一定没有气泡生成 |
| B.向CaCl2饱和溶液中通入少量CO2,溶液中会出现白色沉淀 |
| C.做氯化铵分解实验时,加热试管底部,试管口处有晶体出现 |
| D.向蛋白质溶液中滴加足量饱和NaCl溶液的过程中无固体析出 |
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-==LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x |
| B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锌所消耗的质量最小 |
| C.锂离子电池放电时电池内部Li+向负极移动 |
| D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-==C6Li |
如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
将废旧锌锰电池处理得到含锰混合物,现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
请回答下列问题:
(1)MnOOH中,锰元素的化合价为____。
(2)碱性锌锰干电池的电解质为KOH,Mn02参与的电板反应方程式为 。
(3)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为 。
(4)在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
(5)锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O
①当1molMnO2参加反应时,共有_____mol电子发生转移。
②MnOOH与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:_________________。
③已知:Ksp(MnCO3)=2.3×10-11、Ksp(Mn(OH)2))=2.1×10-13,欲制备MnCO3,选用的加料方式是______(填字母),原因是___________________________________。
a.将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d.以上三种方法都无法制得MnCO3
试题篮
()