工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。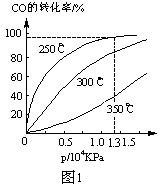
①该反应△H___0(填“>”或“<”)。
②实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。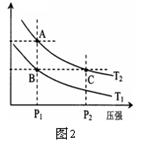
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量。写出该反应的热化学方程式 。
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式 。
(I)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。该电池工作时的正极反应式为: ;
(II)某课外活动小组用如图装置进行实验,试回答下列问题:
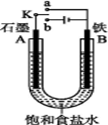
(1)若开始时开关K与a连接,则B极的电极反应为 。 向B极附近滴加铁氰化钾溶液现象是 发生反应的离子方程式
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。习惯上把该工业生产称为
(3)有关上述实验,下列说法正确的是 。
| A.溶液中Na+向A极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应很短一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 |
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)____________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___________________
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:
4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是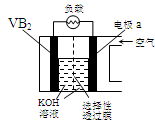
| A.电极a为电池负极 |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−- 22e−→V2O5 + 2B2O3 + 11H2O |
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。 甲
甲  乙
乙
下列有关叙述正确的的是( )
| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4+5O2—―8e-=CO32- +2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是
| A.电子由电极IV通过外电路流向电极I |
| B.装置工作过程中III电极周围出现红色 |
| C.电极II发生还原反应 |
| D.盐桥中Cl—向乙池移动 |
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是 ( )
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
【改编】气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 |
部分电极产物 |
| NO2 |
NO |
| Cl2 |
HCl |
| CO |
CO2 |
| SO2 |
H2SO4 |
A.上述气体检测时,敏感电极均作电池负极
B.检测分别含SO2和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测CO时,敏感电极上的电极反应式为CO+2OH——2e-=CO2+H2O
D.检测NO2时,电解质溶液中的阳离子向对电极移动
摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )
| A.充电时,电能转化为化学能 |
| B.充电时,电解质溶液的pH逐渐增大 |
| C.放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是
| A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+ +2H+  +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1- |
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为2H2+O2===2H2O,负极反应为H2+CO -2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
| A.正极反应为2H2O+O2+4e-===4OH- | B.CO 向负极移动 向负极移动 |
| C.电子由正极经外电路流向负极 | D.电池中CO 的物质的量将逐渐减少 的物质的量将逐渐减少 |
铜锌原电池装置(见图),下列分析正确的是
| A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小 |
| B.原电池工作时,Cu电极流出电子,发生氧化反应 |
| C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
请仔细观察两种电池的构造示意图,完成下列问题:
锌锰电池的构造 碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:
已知:生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
8.0 |
8.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42—+ 4H2O |
| C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
| D.放电时正极附近溶液的碱性增强 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是
| A.水既是氧化剂又是溶剂 | B.放电时正极上有氢气生成 |
| C.放电时OH﹣向正极移动 | D.总反应为:2Li+2H2O=2LiOH+H2↑ |
试题篮
()