某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是
| A.甲为原电池,乙、丙均为电解池 |
| B.电子流动方向 :电极Ⅳ→A→电极I |
| C.当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g |
| D.若丙中的电解质改为CuCl2,电极III的电极反应发生改变 |
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是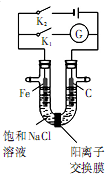
| A.K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B.K1或K2闭合,石墨棒周围溶液pH均升高 |
| C.K2闭合,铁棒上发生的反应为2Cl――2e-=C12↑ |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是
| A.将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的 |
| B.阳极的电极反应式为:C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
有两只串联的电解池(Pt为电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液。电解时 当甲池电极析出6.4gCu时,乙池电极析出21.6g金属,则乙池的溶质可能是( )
当甲池电极析出6.4gCu时,乙池电极析出21.6g金属,则乙池的溶质可能是( ) 
| A.NaNO3 | B.Cu(NO3)2 | C.Al(NO3)3 | D.Ag NO NO 3 3 |
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是
A.若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-=4OH-
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C.(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.C、D、E、F电极均有单质生成,其物质的量比为1∶1∶2∶2
原子序数依次递增的 4 种短周期元素可形成简单离子W2-、X+、Y3+、Z2-,下列说法不正确的是
| A.工业上常采用电解法冶炼Y 单质 |
| B.气态氢化物的稳定性:H2W强于H2Z |
| C.离子半径由大到小:Z2->X+>Y3+>W2- |
| D.W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
用惰性电极实现电解,下 列说法正确的是 ( )
列说法正确的是 ( )
| A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 |
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1: 1 1 |
目前人们正研究开发一种高能电池—钠硫电池,它是以熔融的钠、硫为两极,以导电的β—Al2O3陶瓷作固体电解质,反应为:2Na+xS Na2Sx,以下说法错误的是( )
Na2Sx,以下说法错误的是( )
| A.放电时,钠作负极,硫作正极 |
| B.若此电池用电解饱和NaCl溶液,当阳极产生11.2L(标况)气体时,消耗金属钠23g |
| C.充电时,钠极与外电源的正极相连,硫极与外电源的负极相连 |
| D.充电时,阳极发生的反应是:Sx2--2e=xS |
用铂电极电解100mL HNO3 与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为 ( )
AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为 ( )
A.1mol/L  |
B.2mol/L | C.2.5mol/L | D.3mol/L |
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )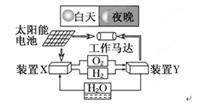
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列有关电化学原理的说法中,错误的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
| C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 |
| D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产生 |
| B.a电极上发生的反应方程式为:2H+ +2e- = H2↑和 4OH--4e- = 2H2O + O2↑ |
| C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化 |
| D.从P到Q点时收集到的混合气体的平均摩尔质量为12g·mol-1 |
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
| A.b电极上的主反应是 SO32—-2e-+H2O=SO42—+2H+ |
| B.若D是混合气体,则可能含有SO2、O2等成分 |
| C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 |
| D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是
| A.向乙中加入适量盐酸,溶液组成可以恢复 |
| B.电解时向乙滴入酚酞溶液,c电极附近变红 |
| C.当b极有64gCu析出时,c电极产生2g气体 |
| D.甲中a极上的电极反应为4OH- -4e-=2H2O+O2↑ |
试题篮
()