第VA族元素及其化合物在生产、生活中有着广泛的应用
(1)砷的电子排布式为 ,N、P、As三种元素的最常见氢化物沸点由高到低的顺序为 ,高纯度砷可用于生产半导体材料GaAs,在GaAs晶体中,Ga、As原子最外电子层均达到8电子稳定结构,则GaAs晶体中砷的配位数为 。
(2)对硝基苯酚水合物是一种具有特殊功能的物质,其结构简式为 。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
a.氢键 b.极性键 c.范德华力 d.离子键 e.σ键
(3)科学家将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是 。
(4)PM2. 5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH、CH3COOONO2 (PAN)等二次污染物。
①N2O结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
②测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
= (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。

(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。

(15分)元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(4)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(5)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸[HOCH2CH(NH2)COOH]。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为_______g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。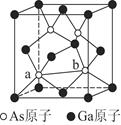
(12分)X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称) ,X3Z+的VSEPR模型名称是 。
(2)M基态原子的电子排布式是 ;
(3)R的单质为面心立方最密堆积(见下图),则一个晶胞中R原子数为 ,R的配位数是 。
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是 .
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。

则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
【化学—选修3—物质结构与性质】(12分)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为_____________。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______________。
(3)与CN-互为等电子体的一种分子为________________(填化学式);l mol Fe(CN)63-中含有σ键的数目为________________。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______________(填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小 体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为____________。
(化学——物质结构与性质,13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
| A |
|
|
||||||||||||||||
| |
|
|
|
M |
Q |
R |
|
|
||||||||||
| |
|
E |
|
|
|
D |
|
|||||||||||
| |
|
|
G |
|
|
|
J |
|
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有 个。该晶体属于 晶体
A.离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种 分子(填极性或非极性)。
(3)请写出D-的电子排布式: 。
(4)M2A2也是直线型分子,1个分子中含有 个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式(用元素符号表示) 。
前四周期原子序数依次增大的元素A,B,C,D中, A是电负性最大的元素,并且A-和B+的电子数相差为8;C和D原子序数相差为2,且都与B位于同一周期,C元素的次外层电子数是最外层电子数的7倍。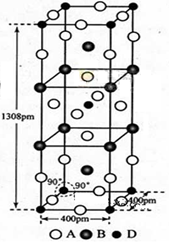
回答下列问题:
(1)D的价层电子排布式为_______。
(2)请用电子式表示A、B两元素形成化合物的过程。 。
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度___ ____g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_ ____;该化合物中存在一个复杂离子,该离子的化学式为___ ____,配位数是_ __。
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。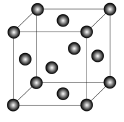
(1)光气(COCl2)是一种应用广泛的原料,下列分子的构型与COCl2分子构型相同的是________(填序号,下同),属于非极性分子的是________。
| A.甲醇(CH4O) | B.甲醛(CH2O) | C.NH3 | D.CO2 |
甲醇(CH4O)与甲醛(CH2O)的相对分子质量相近,通常情况下甲醇呈液态而甲醛呈气态,原因是 。
(2)Fe、Al、Cu三种元素基态原子中未成对电子最多的是________(填元素符号)。
(3)CaC2中C22-与O22+互为等电子体,1 mol O22+中含有的π键数目为________。
(4)已知NaCl、MgO的晶体类型相同,但MgO的熔点远远高于NaCl的熔点,原因是__________。
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为 ,Y的简单氢化物分子式为 。
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为________。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。
①甲的化学式为______________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离U+ 最近的Z2- 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是________________cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
某叶绿素的化学式为C55 H72N4O6Mg,其在人体代谢的中间产物为CO( NH:2)20。
(1)该叶绿素所含元素中,基态原子第一电离能最大的是 (填元素符号,下同);处于s区的元素有 。
(2)已知CO( NH2)2分子中C、N、O原子均达8电子稳定结构,其中N的杂化轨道类型为 ;在CO(NH2)2晶体中存在____ (填序号)o
A.非极性键 B.极性键 C.氢键 D.范德华力
(3)CO(NH2)2的熔点远远低于NaCl.其原因是 。
(4)工业上,用惰性电极电解法除去碱性溶液中的CO( NH2)2,产物均为无毒无害常见物质。则阳极除去CO(NH2)2的电极反应式为 。
氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。
如:Na2O+Cl2==2NaCl+ O2 2CaO+2Cl2==2CaCl2+O2
O2 2CaO+2Cl2==2CaCl2+O2
SiO2+2CCl4==SiCl4+2COCl2 Cr2O3+3CCl4==2CrCl3+3COCl2
请回答下列问题:
(1)COCl2俗称光气,分子中C原子采取sp2杂化,则该分子的结构式是 ,分子的立体构型是 。
(2)写出CCl4的电子式 ,与CCl4互为等电子体的分子和离子分别有 和 (各举一例,写化学式)。
(3)比较下列物质的熔点,用“>”“<”或“=”填写。
Na2O NaCl
CCl4 SiCl4
(4)石英的主要成分是SiO2,晶体类型是 晶体,实验室 (选填“能”或“不能”)用石英坩埚融化氢氧化钠固体。
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。
硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: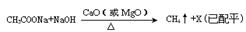 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
试题篮
()