柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如图。

(1)柠檬酸的晶体类型为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为 (填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。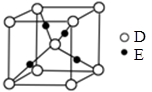
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式的简化形式 。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②二氧化硒分子的空间构型为 。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为 。
键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
则该化合物的化学式是 。
(14分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。
请问答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为 晶体。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题: (答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 ;
(3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是 。
(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为 ;(每个球均表示1个原子)
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相 关 信 息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z的一种核素的中子数为12,质量数为23 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第____周期第____族,
基态W2+的核外电子排布式为 。
(2)X的电负性比Y的____________(填“大”或“小”);X 和Y形成的XY32-离子中,中心原子的杂化类型是___________,其离子的空间构型为为 。
(3)写出Z2Y2的电子式 ,指出其中含有的化学键 ;XY2形成的晶体类型为 。
原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是: ,该主族元素的气态氢化物中,沸点最低的是 (填化学式)。
(2)根据等电子原理分析,BC2+ 中B原子的轨道杂化类型是 。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是 。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第 电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为 ;;
(6)E的基态原子有 种形状不同的原子轨道;E2+ 的价电子排布式为 ;下
图(填甲、乙或丙) 表示的是E晶体中微粒的堆积方式。


甲 乙 丙
(化学---选修物质结构与性质)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
| C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 .(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
( 8分)原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,
1mol Y2X2含有σ键的数目为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 。
(12 分)X、Y、Z、W、Q五种元素其核电荷数依次增大。X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子。
(1)Q2+离子的核外电子排布式为 。
(2)XYZ分子中Y原子轨道的杂化类型为 ,
1molXYZ分子中含有σ键的数目为 。
(3)写出YZW-离子的两种等电子体的化学式: 。
(4)QW的熔点比Q的硫化物的熔点高,其原因是
。
(5)Q晶体属于六方堆积,其晶胞结构见下图,则P点原子
被 个晶胞所共用。
(12分)原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素。用元素符号回答下列问题:
(1)X、Y、Z的电负性由小到大的顺序是 。
(2) N3一与x、Y形成的一种化合物互为等电子体,则N3一的空间构型为 、电子式为 。
(3)同为原子晶体的XY2与ZY2中硬度小的是 。
(4)X和W所形成的某种晶体结构如图7所示,写出:
①基态W2+离子的价电子排布式 ;
②该晶体的化学式 。
(7分)
(1)NF3分子中N原子的杂化轨道类型为__________,该分子的空间构型为________
(2)[Cu(NH3)4]SO4属于配合物,其中 原子提供孤对电子。配合物 Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,Fe(CO)5晶体属于 (填晶体类型)。
(3)金属铜晶体的晶胞结构如图所示(面心立方晶胞):若该晶胞边长为dnm,铜的相对原子质量为64,阿伏加德罗常数为NA,则该晶体的密度为 g/cm3(列表达式)
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni原子的价层电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为 。
丁二酮肟分子中C原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。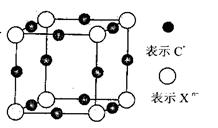
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
试题篮
()