(每空1分,共10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 ;另一种只由B组成的离子与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)D单质晶体堆积为____________________。用●表示D原子,在方框内画出其晶胞图。
碳元素是构成有机物的基础元素。
(1)写出碳元素核外电子排布式 。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是 。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式 。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为 g/cm3。
下列各组物质:
①O2和O3 ②H2和D2 ③12C和14 C ④石墨和足球烯(C60)
⑦ CH3CH2OH(乙醇)和 CH3-O-CH3(二甲醚)
(1)互为同素异形体的是_____________; (2)互为同位素的是_______________。
(3)互为同分异构体的是_____________; (4)同一种物质的是_______________。
(11分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;
(2)写出A、B、C形成的化合物M的电子式________;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;
(4)D单质与M的水溶液反应的离子方程式:________
【化学——选修3:物质结构与性质】
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
【化学——物质结构与性质】13分)
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
⑴写出基态铬原子的外围轨道表示式_______________________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为________。
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子。
⑶在①苯、②C2H4、③CCl4、④CO2五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CO2分子的空间构型是______________。
【化学—物质结构与性质】氯是一种非常重要的非金属元素。
(1)氯元素的基态原子的价电子层排布式是 。
(2)氯化氢的沸点远低于氟化氢,液态氟化氢的化学式有时写成(HF)n,其原因是: .
(3)光气(COCl2)中C原子采取 杂化成键,其碳氧原子间的共价键含有 (填“σ”或“π”键及个数)。
(4)元素Cu的一种氯化物的晶胞结构如图所示(黑球表示铜原子,白球表示氯原子),该氯化物的分子式 ,它可与浓氨水反应生成无色溶液,在空气中放置一段时间,最终溶液变成深蓝色,则深蓝色溶液中生成配合物为 (填化学式)。
【物质结构与性质】
X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的p轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的最外层电子数与Z相同,其余各电子层均充满电子。
请回答下列问题:
(1)X、Y、Z三种元素的第一电离能从小到大的顺序是 (用元素符号表示,下同);
(2)W元素原子核外电子排布式是 ;
(3)Z元素与氢元素形成的化合物熔点比Y元素的氢化物熔点高,原因是 ;
(4)X的一种氢化物相对分子质量为42,分子中含有σ键和π键的个数比为8︰1,则该分子中X原子的杂化类型是 和 。
(5)Y的最简单氢化物可以和W2+形成配位键,而X的最简单氢化物则不行,其原因是 。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
| A |
|
R |
|||||||||||||||
| B |
|
|
|
|
|
|
|
|
|
|
|
C |
D |
E |
F |
T |
|
| G |
H |
I |
J |
|
K |
L |
|
||||||||||
| |
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为_______ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为 。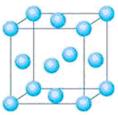
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题:
(1)C原子基态时电子排布式为 。
(2)B、C两种元素第一电离能为: > (用元素符号表示)。试解释其因: 。
(3)任写一种与AB_离子互为等电子体的离子 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,∠EDE= ;E的配位数是 ;已知晶体的密度为 g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用 、NA的计算式表示)
、NA的计算式表示)
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 _________________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________________,其原因是____________________;
②电子总数相同的氢化物的化学式和立体结构分别是_________________________.;
(5)W和Q所形成的结 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于 分子(填“极性”或“非极性”)。
(2)当n=3时,A与B形成的晶体属于 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时核外电子排布式为 ,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是 。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。该周期部分元素氟化物的熔点见下表。
(1)A原子核外共有________种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的原子核外电子排布式______________________;
(3)解释上表中氟化物熔点差异的原因:__________________________;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是________(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为___________(填离子符号)。
核能源已日益成为当今世界的主要能源。
(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2(CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如图),则UO2晶体U4+的配位数为 ;三碳酸铀酰铵中含有化学键类型有 ;
| A.离子键 | B.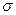  键 键 |
C.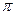 键 键 |
D.氢键 E.配位键 |
根据价层电子对互斥理论推测CO32—的空间构型为 ;写出一种与CO32—互为等电子体且属于非极性分子的微粒的化学式 。
(2)为了获得高浓度235U,科学家们采用“气体扩散法”;到目前为止,UF6是唯一合适的化合物。UF6在常温常压下是固体,在56.4℃即升华成气体。UF6属于 晶体。
(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以为核爆炸或核反应堆泄漏事故的信号核素。写出131I基态原子的价电子排布式 。
试题篮
()