【物质结构与性质】
X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的p轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的最外层电子数与Z相同,其余各电子层均充满电子。
请回答下列问题:
(1)X、Y、Z三种元素的第一电离能从小到大的顺序是 (用元素符号表示,下同);
(2)W元素原子核外电子排布式是 ;
(3)Z元素与氢元素形成的化合物熔点比Y元素的氢化物熔点高,原因是 ;
(4)X的一种氢化物相对分子质量为42,分子中含有σ键和π键的个数比为8︰1,则该分子中X原子的杂化类型是 和 。
(5)Y的最简单氢化物可以和W2+形成配位键,而X的最简单氢化物则不行,其原因是 。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1、02 |
2、27 |
0、74 |
1、43 |
0、77 |
1、10 |
0、99 |
1、86 |
0、75 |
1、17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: 。(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是 。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形成 个σ键, 个π键。
(3)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第 族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
②不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是 。
有关下列表述
①16O2与18O2互为同位素
②C2H4与C6H12互为同系物
③淀粉与纤维素互为同分异构体
④白磷与红磷是同素异形体,它们之间的转化是物理变化
⑤碳与硅是同主族元素,故CO2与SiO2结构相似,性质相似
⑥PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
| A.都不正确 | B.只有①③⑤正确 |
| C.只有②④⑤正确 | D.只有①②⑥正确 |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A.两种物质的阴离子半径都比阳离子半径小 |
| B.与水反应时,水都做氧化剂 |
| C.与盐酸反应都只生成一种盐 |
| D.溶于水,所得溶液都能使无色酚酞变红 |
下列说法正确的是
| A.H216O、D216O、H218O、D218O互为同素异形体 |
| B.有单质生成的反应一定是氧化还原反应 |
| C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF |
| D.电子层结构相同的不同离子,其半径随核电荷数的增大而减小 |
X、Y、Z 、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:
、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:
⑴ L的元素符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ,B—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,B—空气燃料电池放电时:负极的电极反应式是: 。
⑶硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的特征构型的电子排布式为 ,其最高价氧化物对应的水化物化学式为 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaOH 溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式: ;
Ⅰ.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)若知上述反应每产生2.24LCO气体(折为标准状况)放出Q kJ的热量,则其热化学方程式为 
(3)用轨道表示式表达Si 核外电子排布情况 
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4中硅的化合价为 ,Si3N4所属的化合物类型是 (填离子化合物or共价化合物),在前四周期的元素中,未成对电子数最多的元素的电子排布式为
Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染 。例如:
。例如:
CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(17分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)B 、D两种元素的氢化物中,沸点大的是 (写化学式号),其原因是
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”,用元素符号表示)
(5)E位于周期表的第 周期,第 族;其原子结构示意图为 。
(6)A与B形成的A2B2化合物含 键(填“极性”或“非极性”),属 分子。(填“极性”或“非极性”)其电子式为:______________________________。
下表中a、b、c…为周期表中部分元素,回答下列问
| a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
f |
y |
h |
i |
|
| |
b |
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
j |
|
| c |
|
|
|
|
|
|
d |
|
|
|
g |
|
l |
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在表中用线画出元素周期表的边界
(2)请写出上述元素d3+的核外电子排布式 ;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序 (写元素符号),判断依据是:
(4)请写出e元素的原子价电子轨道表示式 ;
(5)ya3分子的电子式是 ,其分子的空间构型是 。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________ 。
.下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的,写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaC1、MgC12等。请回答
(1)冰比硫化氢熔点高的原因是 ;
其分子中氧原子的杂化轨道类型为 ;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol—1 |
I1 |
I2 |
I3 |
I4 |
| X |
578 |
1817 |
2745 |
11578 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
496 |
4562 |
6912 |
9543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示);
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图。
①铁元素基态原子价电子排布式为 ;
②已知CN—与N1结构相似,1mol CN-中 键数目为 。
键数目为 。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
| A |
|
R |
|||||||||||||||
| B |
|
|
|
|
|
|
|
|
|
|
|
C |
D |
E |
F |
T |
|
| G |
H |
I |
J |
|
K |
L |
|
||||||||||
| |
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为_______ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为 。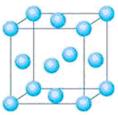
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
阅读下表中短周期主族元素的相关信息。
请回答:
(1)写出E在元素周期表中的位置:________;C的简单离子的结构示意图:______;
(2)写出A2B2晶体中存在的化学键有:_______________________;
(3)常温下,0.1 mol·L-1X溶液的pH 7(填“>”、“=”或“<”)。简述X可以做家用消毒剂的理由:_______________________________________。
试题篮
()