已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法不正确的是
| 元素性质 |
元素编号 |
||||||
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
| 原子半径(nm) |
0.073 |
0.075 |
0.152 |
0.110 |
0.099 |
0.186 |
0.143 |
| 最高正化合价 |
无 |
+5 |
+1 |
+5 |
+7 |
+1 |
+3 |
| 最低负化合价 |
-2 |
-3 |
无 |
-3 |
-1 |
无 |
无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
下表是在相同温度下,三种酸的一些数据,下列说法正确的是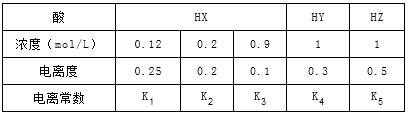
| A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1 |
| B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大 |
| C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) |
| D.相同温度下,K5>K4>K3 |
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:
下列说法正确的是
| A.沉淀甲可能是AgBr |
| B.沉淀丙一定是BaCO3 |
| C.气体甲的成份只有4种可能 |
| D.肯定存在的离子有AlO2-、S2-、SO32-、Na+ |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6g铜粉。向乙中逐渐加入铁粉,最多能溶解14.0g铁粉。 (假设硝酸只被还原为NO气体)。下列分析或结果错误的是
| A.原混合酸中NO3—物质的量为0.1 mol |
| B.乙中最多产生气体是0.2mol |
| C.原混合酸中HNO3浓度为1.0 mol·L-1 |
| D.原混合酸中H2SO4浓度为2.5 mol·L-1 |
【改编】向甲、乙、丙三个恒温恒容的密闭容器中,发生反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
| 容器 |
甲 |
乙 |
丙 |
| 容积(L) |
0.5 |
0.5 |
0.5 |
| 能量变化(kJ) |
Q1 |
Q2 |
Q3 |
| 反应物起始量 |
A、B各1 mol |
A、B各0.5 mol |
C 0.5 mol |

下列说法正确的是
A.x=1
B.Q1=2Q3
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时充入A、B、C各2mol,则此时向逆反应方向移动
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究。
下列有关说法不正确的是:
| A.由Ⅰ可知X中一定存在Fe2O3、Cu |
| B.无法判断混合物中是否含有Al2O3 |
| C.1.92 g固体成分为Cu |
| D.原混合物中m(Fe2O3):m(Cu) =1:1 |
【改编】向含等浓度FeCl3、Al2(SO4)3的混和液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断错误的是
| A.OA段可能发生的反应有:2Fe3++6OH-+3Ba2++3SO42-=3BaSO4↓+2Fe(OH)3↓ |
| B.AB段溶液中加入KSCN溶液显血红色 |
| C.C点的沉淀为:Fe(OH)3和 BaSO4 |
| D.C点后的溶液中:K+、Na+、NO3-、Cl-能大量共存 |
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: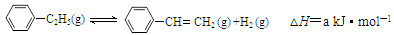 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.004mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆)
某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下
下列有关推断合理的是
| A.根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B.沉淀H为Al(OH)3、BaCO3的混合物 |
| C.溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D.若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)="0.05" mol·L-1 |
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下: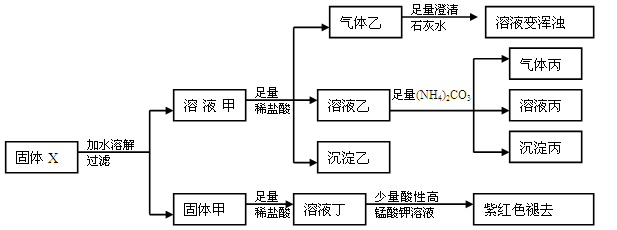
已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
下列说法正确的是
| A.气体乙和气体丙都为纯净物 |
| B.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有NaHCO3、Na2CO3 |
| C.溶液丁中的阳离子一定只含H+、Fe2+ |
| D.溶液甲中一定含有AlO2-,可能含有CO32- |
如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:
LiMnO2 + C6 Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
| A.K与N相接时,A极为负极,该电极反应式为:LixC6 - xeˉ= C6 + xLi+ |
| B.在整个充电或放电过程中都只存在一种形式的能量转化 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.K与M相接时,A极发生氧化反应,LiMnO2 -xeˉ = Li1-xMnO2 + xLi+ |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍。Z是常见的金属,其原子的电子层数等于主族序数。W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.原子半径按X、Y、Z、R、W的顺序依次增大 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.Z与Y形成的化合物可作为耐高温材料 |
| D.熔沸点:X2R > X2Y |
【改编】短周期的两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法错误的是
| A.若m=2,则X必定为第ⅡA元素 |
| B.若a=m,则有两种金属元素 |
| C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 |
| D.若a=b=3,8>m>n>b,则元素非金属性:X>Y |
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A.元素B和E的氧化物对应的水化物均为强酸
B.工业上常用电解元素C、D的氯化物来制取它们的单质
C.元素C、D、E的最高价氧化物对应的水化物之间均可相互反应
D.C的单质能与A的氧化物发生置换反应
试题篮
()