已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮。如:
现有化学式C7H14的某烯烃,它与H2加成后生成2,3–二甲基戊烷,它经臭氧氧化后在Zn存在下水解成乙醛和一种酮,据此推知该烯烃的结构简式为:
A. |
B. |
C. |
D. |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是
| A.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0.05mol |
| D.e曲线表示的离子方程式为: Al(OH)3+3H+= Al3++3H2O |
将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体。将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为
| A.物质的量 FeS:CuO:Fe =1:1:1 | B.物质的量 C:CuO:Fe =3:2:2 |
| C.质量 MnO2:CuO:C=5.5:8:12 | D.质量 Fe:C:CuO=7:5:3 |
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
A.HA溶液加水稀释后,溶液中 的值减小 的值减小 |
B.HA的电离常数 (x为滴定分数) (x为滴定分数) |
| C.当滴定分数为100时,溶液中水的电离程度最大 |
| D.滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 |
氯化铜 |
氧化亚铜 |
氢氧化亚铜(不稳定) |
氯化亚铜 |
| 颜色 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
红色 |
橙黄色 |
白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e-¯ ═ H2↑+ 2OH-¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
下表是部分短周期元素性质的数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
| 最高化合价 |
/ |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
| 最低化合价 |
-2 |
/ |
/ |
-3 |
-1 |
/ |
-3 |
/ |
下列说法不正确的是
A.元素原子序数④大于⑦
B.②③号元素不可能处于同一周期
C.⑤号元素最高价氧化物对应水化物的酸性最强
D.⑧号元素是金属元素
某种橡胶分解产物为碳氢化合物,对这种碳氢化合物作如下实验:
①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过石灰水,石灰水增重2.2 g。
②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍。
③该碳氢化合物0.1 mol能和32 g溴起加成反应.
④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。
下列说法正确的是
| A.该碳氢化合物为2-甲基-1,3-戊二烯 |
| B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物 |
| C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物 |
| D.该碳氢化合物与足量氢气加成时可以生成正戊烷 |
相对分子质量均为88的饱和一元醇和饱和一元羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)
| A.8种 | B.12种 | C.16种 | D.18种 |
部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.0.1mol/L的NaHCO3溶液中:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O  HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO  H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中,Cl2(aq)、HClO和ClO-分别在三者中所占的物质的量分数(α)随pH变化的关系如图所示。下列表述正确的是
A.Cl2(g)+ H2O  2H+ + ClO-+ Cl- K=10-10.9 2H+ + ClO-+ Cl- K=10-10.9 |
| B.pH=7.5时,用氯处理饮用水体系中,c(Cl-) + c(HClO) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
| A.Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存 |
| B.向0.1mo1/L该物质的溶液中清加0.L/molNaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如上图所示 |
| C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 |
| D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42--完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓ |
用酸性氢氧燃料电池电解苦卤水(含Cl—、Br—、Na+、Mg2+)的装置如下图所示(a、b为石墨电极),下列说法正确的是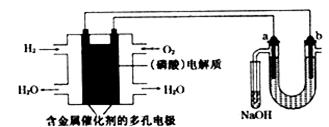
| A.电池工作时,正极反应式为O2+2H2O+4e-=4OH- |
| B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C.试管中NaOH溶液是用来吸收电解时产生的Cl2 |
| D.当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.02mol气体 |
氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,②H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是
A.氢氟酸的电离方程式及热效应可表示为: HF(aq)  F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1 F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1 |
| D.当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
(12分)稀土元素是周期表中ⅢB族钪、钇和镧系元素之总称,金属活泼性仅次于碱金属和碱土金属元素,它们的性质极为相似,常见化合价为+3价。无论是航天、航空、军事等高科技领域,还是传统工农业,稀土的应用几乎是无所不在。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。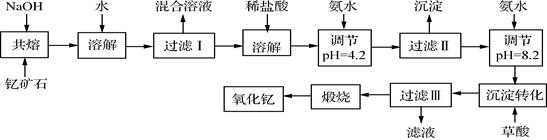
已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表。
| 离子 |
开始沉淀时 的pH |
完全沉淀时 的pH |
| Fe3+ |
2.7 |
3.7 |
| Y3+ |
6.0 |
8.2 |
②Be(OH)2+2NaOH Na2BeO2+2H2O
Na2BeO2+2H2O
请回答下列问题:
(1)过滤Ⅲ所得滤液的溶质主要有______________。
(2)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(3)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= 。
Fe(OH)3+3H+的平衡常数K= 。
(4)写出煅烧过程的化学方程式 。
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g) 2C(g) ΔH=a kJ·mol-1
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |

下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
试题篮
()