下列离子方程式或化学方程式中正确的有
①向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
②向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO
③将CO2气体通过过氧化钠固体:2CO2+2Na2O2===2Na2CO3+O2
④将SO2气体通过过氧化钠固体:2SO2+2Na2O2===2Na2SO3+O2
⑤氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
⑥在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-===3Fe3++2H2O+NO↑
⑦硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-===Fe(OH)3↓
⑧硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-===Fe2S3
| A.2项 | B.3项 | C.4项 | D.5项 |
将3.2g铜与过量硝酸(8mol/L,30ml)充分反应后,硝酸的还原产物为NO2和NO ,反应后溶液中含a mol H+,则此溶液中所含NO3-的物质的量为
| A.(0.2+a)mol | B.(0.1+a)mol | C.(0.05+a)mol | D.amol |
准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为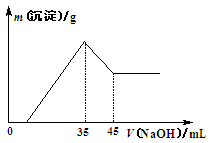
| A.1.75 mol·L-1 |
| B.3.50 mol·L-1 |
| C.0.85 mol·L-1 |
| D.无法确定 |
全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有VO2+和Cr2O72-,现向其溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好是VO2+→VO2+,Cr2O72-→Cr3+.再滴入2.OOmL0.02000mol/L的KMnO4溶液,又恰好是VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+,则原溶液中Cr元素的质量为
| A.156 mg | B.23 4 mg | C.31.2 mg | D.46.8mg |
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A.元素A所形成的氧化物只有一种
B.元素B的最高价氧化物对应的水化物为强酸
C.元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应
D.氢化物的稳定性:A>B
某雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验: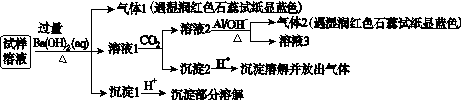
已知:3NO3-+ 8Al + 5OH-+ 2H2O 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
| A.试样中肯定存在NH4+、Mg2+、SO42-和NO3- |
| B.试样中一定不含Al3+ |
| C.试样中可能存在Na+、Cl- |
| D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
根据下列有关图象,说法正确的是
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
下列离子方程式书写正确的是
①等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3·H2O + H2O
②氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = 4NH4+ + AlO2 – + 2H2O
③向次氯酸钙溶液中通入过量的二氧化硫 Ca2+ + 2ClO – + SO2 + H2O = CaSO3↓+ 2HClO
④已知等浓度的碳酸钠、次氯酸钠、碳酸氢钠PH逐渐减小,向次氯酸钠溶液通少量二氧化碳:ClO- +CO2 +H2O =" HClO" + CO32-
⑤过氧化钠固体与水反应:2O22‾+2H2O=4OH‾+O2↑
⑥氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32‾+H2O
⑦澄清的石灰水中加人过量的NaHCO3溶液:Ca2++OH‾+HCO3‾=CaCO3↓+H2O
⑧将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH‾=Al(OH)3↓+AlO2‾+2H2O
⑨向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
| A.①③⑥⑨ | B.②④⑤⑨ | C.③④⑦⑧ | D.①⑧⑨ |
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)  NH3(g) + HI(g)
NH3(g) + HI(g)
b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因 。
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
| A.取ag混合物充分加热,剩余bg固体 |
| B.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg |
| C.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 |
| D.取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
11.2 g Cu在某浓硝酸中完全溶解,反应产生NO2和NO混合气体3.36L(标准状况),则混合气体中NO2和NO的体积比为( )
| A.1:l | B.1:2 | C.1:3 | D.2:l |
向l mL 0.5mol·L-1AlCl3溶液中加入3 mL饱和NaF溶液,再加入l mL 3mol·L-1氨水,没有生成白色沉淀,其最主要的原因是( )
| A.3mol·L-1氨水的浓度不够大,溶液的碱性不够强 |
| B.NaF溶液碱性较强,Al3+完全反应生成AlO2-,而AlO2-不能与氨水反应生成Al(OH)3 |
| C.氨水为弱碱溶液,Al3+不与弱碱反应 |
| D.Al3+与F-结合生成新物质,溶液中几乎没有Al3+ |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,下图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )

| A.70mL | B.100mL | C.120mL | D.130mL |
试题篮
()