已知反应:2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是_______________________
(2)用单线桥法表示反应中电子转移的方向和数目
2H2CrO4 + 3H2O2 2Cr(OH)3 + 3O2↑+ 2H2O
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为_______________________
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A的名称是______,B的名称是______, C的化学式为______。反应的化学方程式分别为: , 。
(1)相同物质的量的O2和O3的质量比________,分子个数比为________,所含氧原子的个数比为________。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为______。此溶液中Mg2+的物质的量浓度为________,Cl-的物质的量浓度为___________________。
Ⅰ:如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:
2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
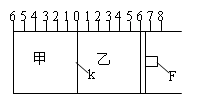
(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为___________。
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处, 则乙中可移动活塞F最终停留在右侧的刻度不大于 ;
Ⅱ:若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(4)测得甲中A的转化率为b,则乙中C的转化率为 ;
(5)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
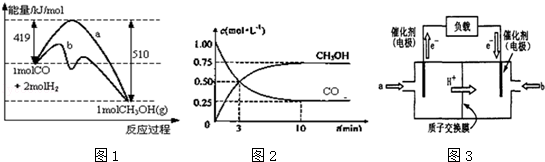
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g) ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l) ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g) ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g) N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA__________vB(填“>”、“<”或“=”);若打开活塞K2,气球B将__________(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将____________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将____________,B中NO2的转化率将__________(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,__________中的颜色较深。
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式 。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)="2HCl" (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: ; ②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;

若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
按要求作答:
(1)石灰石与稀硝酸反应的离子方程式:_____________________________
(2)硫酸铜溶液与氢氧化钾溶液反应的离子方程式:_____________________
(3)写出HCl只做氧化剂的反应化学方程式:______________________________
(4)写出碳单质做还原剂的反应化学方程式:________________________________
(1)有下列四种物质:A.青霉素 B.葡萄糖 C.苯甲酸钠 D.柠檬黄
请你根据题意,选择恰当的选项用字母代号填空:
可直接进入人体血液补充能量的是 ;
有阻止多种细菌生长的功能的抗生素类药物是 。
(2) 防治环境污染和改善生态环境已成为全球的共识。
①下列物质不会污染室内空气的是 (填字母,下同);
A. 氮气(N2) B. 一氧化碳(CO) C. 甲醛(HCHO)
②下列有关环境污染防治的叙述中,不正确的是 ;
A.推广使用无铅省油可减少铅污染
B.室外焚烧塑料垃圾可减少大气污染
C.淘汰含磷洗衣粉可降低水体富营养化程度
(1)了解用药常识,有利于自我保健。现有下列药物:
A、阿司匹林 B、青霉素 C、抗酸药 D、麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是 。
②治疗胃酸过多,但患有严重的胃溃疡,应该选择 。
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是 。
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是
(2)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是 (填字母)。A.CO2 B.N2 C.NO2
②工业废水需处理达标后才能排放。
下列废水处理的方法合理的是 (填字母)。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
食物是人类赖以生存的物质基础,食物中能够被人体消化、吸收和利用的各种营养物质称为营养素。回答下列问题:
(1)人体需要的营养素主要有糖类、蛋白质、维生素、水、 和 。
(2)下列病患是由于缺乏维生素引起的是
A.夜盲症 B.佝偻病 C.坏血病
(3)有关维生素C说法不正确的是
A.蔬菜应先洗后切 B.蔬菜应慢火慢煮
C.维生素C可使溴水褪色 D.维生素C可用食品添加剂
在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如下图所示,则:

(1)“O”点导电能力为0的理由是_________________________。
(2)用湿润的pH试纸测量a处溶液的pH,测量结果_________(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①pH:__________ ;
②醋酸的电离度:_________ ;
③醋酸的电离平衡常数:__________ ;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:___________。
(4)若使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施有(答二类不同的物质):
①___________________②_____________________。
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是 。
| A.c(H+) | B.H+个数 | C.CH3COOH个数 | D.c(H+)/c(CH3COOH) |
常温常压下,断裂1 mol(理想)气体分子化学键所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据:
| 化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
| C-F |
427 |
C-Cl |
330 |
C-I |
218 |
| H-H |
436 |
S=S |
255 |
H-S |
339 |
请完成下列问题。
(1)由表中数据规律预测C-Br键的键能范围:________<C-Br键能<________(填写数值和单位)。
(2)热化学方程式2H2(g)+S2(g) ===2H2S(g) ΔH= Q kJ·mol-1;则Q=____________________。
(3)已知下列热化学方程式:
O2 (g) ="==" O2+(g)+e-ΔH1= +1 175.7 kJ·mol-1
PtF6(g)+e-="==" PtF6- (g) ΔH2= —771.1 kJ·mol-1
O2+PtF6- (s) ="==" O2+ (g)+PtF6- (g) ΔH3= +482.2 kJ·mol-1
则反应O2(g) +________(g)===O2+PtF6- (s) ΔH=________kJ·mol-1。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)。体系中,n(NO)随时间的变化如表:
2NO2(g)。体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: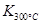 >
>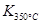 ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 。
用O2表示从0~2 s内该反应的平均速率v= 。
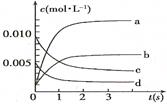
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
试题篮
()