某化学课外小组用如图装置制取溴苯并探
究该反应的类型。先向分液漏斗中加入苯和液溴,
再将混合液滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:_____________
___________________________。
(2)实验结束时,打开A下端的活塞,让反应
液流入B中,充分振荡,目的是 。
(3)C中盛放CCl4的作用是 。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
| |
向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
| 方法一 |
|
|
| 方法二 |
|
|
有机物A分子组成为C4H9Br,A中有一个支链,在一定条件下A可发生如下转化

|



(9分)用下图实验装置制取乙酸乙酯。回答以下问题:
(1)在A试管中加入乙醇、乙酸和浓硫酸的顺序是 _______________________________。
(2)写出A试管中发生反应的化学方程式___________________________________________
(3)B试管中所装液体应为___________,乙酸乙酯生成后,将在该溶液的______(填“上”或“下”)层,分离出该产品所需的主要仪器是_________________________________________
(4)该装置用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处球形干燥管的作用有① _________________________________________________________
② _________________________________________________________________________
某化学兴趣小组用下图所示装置进行探究实验,以验证烧瓶中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到溴水褪色,烧瓶中浓硫酸与乙醇的混合液变为棕黑色。
(1)烧瓶中除了浓硫酸和乙醇之外,还放入了___________,其作用是_______________
(2)写出该实验中生成乙烯的化学方程式:______________________________________
(3)B瓶中盛装的溶液是___________,其作用是________________________________
(4)C瓶中盛装的溶液是___________,其作用是_________________________________
(5)考虑到A中混合液反应的复杂性,如果没有B、C装置,D中溴水褪色的现象不能证明A的烧瓶中有乙烯生成且具有不饱和性,其理由是___________(填下列这项的序号)。
①乙烯与溴水易发生取代反应 ②使溴水褪色的反应未必是加成反应
③使溴水褪色的物质未必是乙烯 ④浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
 |
1)在实验室中用MnO2和浓盐酸反应制备氯气,其反应的化学方程式为_______________;
(2)某同学欲制取2.24L(标况)氯气,其做法是称取8.7g二氧化锰与40mL10mol·L—1的浓盐酸反应,其做法能否达到目的 _______________ (填“能”、“或“不能”)。通过计算和文字叙述说明之。
25.课本“交流•研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
①____________ kJ ②____________kJ ③____________kJ
根据下图转化回答有关问题:
(1)①写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
②B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
①浓硫酸的作用是_______________ _______________。
②饱和碳酸钠溶液的主要作用_______________。
③装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
| A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水 |
| B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸 |
| C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸 |
| D.正反应的速率与逆反应的速率相等 |
E.混合物中各物质的浓度不再变化
为了验证镁和铝的金属性强弱,某同学欲设计实验验证。
提供的试剂有:镁带、铝条、水、盐酸、浓硫酸。
(1)所选试剂为_______________;
(2)发生反应的化学方程式为_______________;
(3)请简要叙述其操作过程及现象_______________。
将质量相等的锌片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。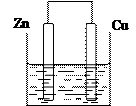
(1)此装置为 _______________,该装置中发生反应总的离子方程式为 _______________,铜片周围溶液会出现 _______________的现象。
(2)若2 min后测得锌片质量减少1.3g,则导线中流过的电子为_______________mo1。
(3)该装置的电解质溶液还可以用 _______________(答一种即可)。
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 |
| B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1 数为V1 |
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是 → → →D→ (均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响? (填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________ ______________________________________。
______________________________________。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________________;
__________________________________________。
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是_____________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中氢气生成速率,还可采取的措施有___________________________
____________________________________________________________ (答两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/L H2SO4(mL) |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液(mL) |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O(mL) |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________________________________________________________________________________________________________。
实验室常用下图装置制取氨气:请回答下列问题:
(1)写出图中带有编号的仪器名称a___________ b___________。
(2)写出该实验中制取氨气的化学方程式:________________________________。
(3)检验氨气是否收集满的方法是__________________________________。
(4)不用排水法收集氨气的原因是:_________________________。
(5)试管口棉花的作用是:_________________________________。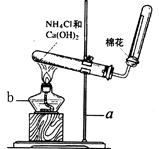
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 |
实验现象 |
||||
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。 ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器、材料: 略 药品: 略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 |
实验现象 |
有关离子方程式 |
| |
A |
|
| |
B |
不填 |
| |
C |
不填 |
| |
D |
不填 |
| |
E |
|
(4)实验结论:____________________________________________________。
(5)请用原子结构理论解释上述结论的原因___________________________
(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A口导入气体,可收集下列中的 (填序号,下同)气体。若烧瓶充满水,可收集下列中的________气体。
①NO ②NH3 ③SO2 ④NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是 __________________________________________________。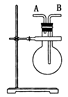
已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置(加热装置略去)。
(1)如图所示,连接好仪器装置之后,首先需进行的操作是 。
(2) 向装置A中大试管中加入1,2二氯乙烷和 (写名称);并向装置C中试管里加入适量溴水。A中发生反应的化学方程式是 。
(3)与装置A中大试管相连接的长玻璃管除导气外的作用是 __________________,装置B的作用是 _________________。
(4)证明1,2 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。
试题篮
()