实验室制乙烯通常采用乙醇与浓硫酸(体积比为1:3)混合加热到170℃制得,反应过程中乙醇常被炭化,溶液中有黑色物质出现,随着反应进行炭化现象越来越严重,同时制得的乙烯气体中通常会含有CO2、SO2等气体,为确认混合气体中含有乙烯和二氧化硫,可让混合气体依次通过下图实验装置。(可供选择的试剂:品红溶液、氢氧化钠溶液、溴水、酸性高锰酸钾溶液、浓硫酸,试剂可重复使用。)
A.①②中盛放的试剂分别为① ;② ;(填试剂名称)
B.能说明二氧化硫气体存在的现象是 。
C.能确认含有乙烯的现象是 。
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1) 完成该实验还缺少的仪器是 。
(2)本实验需量取浓硫酸的体积为 mL,量取时应选择的仪器是(填上述序号) 。
(3)在容量瓶使用方法中,下列操作不正确的是(填序号) 。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①所用的浓硫酸长时间放置在密封不好的容器中
②. 容量瓶用蒸馏洗涤后残留有少量的水
③. 定容时俯视溶液的液凹面
德国化学家李比希最早提出关于有机化合物中元素定量分析方法:用CuO作氧化剂(在氧气流中)将有机物氧化,再对产物进行分析,从而确定有机物的实验式。现取m g某种氨基酸(CxHyOzNp)在纯氧中完全燃烧,生成CO2、H2O和N2。实验在下图装置中进行:
请回答下列问题:
⑴实验开始时,先要通一段时间的氧气,其理由是__________________________。
⑵ 装置图中需要加热的仪器有(用字母填空,下同)_________,操作时应先点燃________处的酒精灯。
⑶A装置中发生反应的化学方程式是______________________________________。
⑷ D装置的作用是______________________________________________。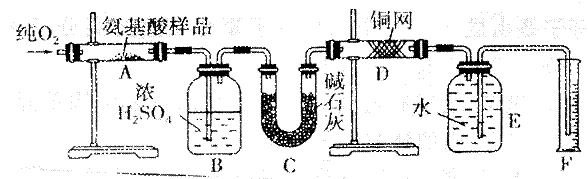
⑸ 读取N2的体积是,应注意:①____________________________________________;
②_____________________________________________________。
⑹ 实验中测得N2的体积为V mL(已折算成标准状况下)。为确定此氨基酸的分子式,还需要的有关数据有_______________。
| A.生成二氧化碳气体质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的相对分子质量 |
实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤是 (填序号)。
(2)鉴定1-氯丙烷中氯元素的操作步骤是 (填序号)。
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊
试液;⑤为尾气吸收装置。
请填写下列空白:
⑴ 制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因:
①_______________________________________________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
反应完毕经冷却后,②的试管中有大量晶体析出。下图
中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为_______色 |
______________________________________ |
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题: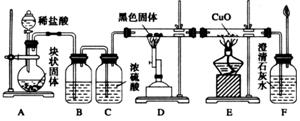
(1)写出装置A中所发生反应的离子方程式:__________________________________。
(2)装置B中的试剂是饱和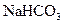 溶液,其作用是_______________________。
溶液,其作用是_______________________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是____
___________________________________________________________________________。
(4)装置D中反应的化学方程式为___________________________________________。
(5)根据实验中的_____________________________________________________现象,
可证明CO具有还原性,有关反应的化学方程式是________________________________。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置_________与________之间连接下图中的__________装置(填序号)。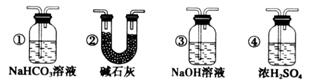
(1)应用托盘天平称取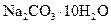 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的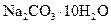 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用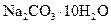 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
(5)若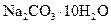 晶体中混有少量
晶体中混有少量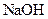 固体,且用所配制的
固体,且用所配制的 溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
实验室需用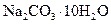 晶体配制
晶体配制 的
的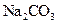 溶液,请回答下列问题。
溶液,请回答下列问题。
(1)应用托盘天平称取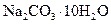 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的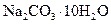 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用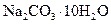 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
(5)若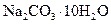 晶体中混有少量
晶体中混有少量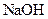 固体,且用所配制的
固体,且用所配制的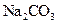 溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:(1)浓硫酸的作用是 ;
写出合成乙酸乙酯的化学方程式:
(2)球形干燥管C的作用是 。
(3)饱和Na2CO3溶液的作用( )
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,
分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃
左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
为了检验和除去下表中的各种所含的杂质(括号里的物质),请从(I)中选出适当的
检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物 质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
|
|
| 酒 精(水) |
|
|
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 |
(II)除杂试剂:a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:(1)浓硫酸的作用是 ;
写出合成乙酸乙酯的化学方程式:
(2)球形干燥管C的作用是 。
(3)饱和Na2CO3溶液的作用( )
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,
分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃
左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
为了检验和除去下表中的各种所含的杂质(括号里的物质),请从(I)中选出适当的
检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物 质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
|
|
| 酒 精(水) |
|
|
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 |
(II)除杂试剂:a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
按以下装置图进行实验,填写有关现象及化学方程式
①简述如何检验此装置的气密性
。
②B中浓硫酸的作用是____________________
③C中发生反应的化学方程式为
④D中现象是____________________,
反应的离子方程式是
⑤E中收集的气体是____________________
实验室要用98%(密度为1.84g.cm-3)的硫酸配制3.68mol/L的硫酸溶液500ml。
(1)需准确量取98%的硫酸 ml。
(2)要配制3.68mol/L的硫酸溶液500ml,必须用到的仪器是(填写序号) 。
①500ml量筒 ②烧杯 ③1000ml容量瓶 ④500ml容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶⑧玻璃棒
(3)若配制3.68mol/L的硫酸溶液的其它操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是 。
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 |
| D.用胶头滴管向容量瓶中加水时,仰视观察溶液凹液面与容量瓶刻度相切 |
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。启东市近期一次的“空气质量日报”显示,启东的空气已受到一定程度的污染。一研究性学习小组对启东市的空气污染情况进行了下列研究。
⑴小组一同学初步分析得出,启东市空气污染的主要原因可能有如下三种:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成启东市空气污染的最主要原因调查了本市100名市民和100位环保部门人士。调查结果如下图所示:
空气污染原因调查人数分布图
从市民和环保人士的不同观点上分析,你认为造成启东市空气污染的主要有害成分是
(用化学式表示)
⑵空气污染形成酸雨。研究性学习小组对启东市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是 ,通过计算得到的结论是 (以定量描述)
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是
(填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。启东市近期一次的“空气质量日报”显示,启东的空气已受到一定程度的污染。一研究性学习小组对启东市的空气污染情况进行了下列研究。
⑴小组一同学初步分析得出,启东市空气污染的主要原因可能有如下三种:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成启东市空气污染的最主要原因调查了本市100名市民和100位环保部门人士。调查结果如下图所示:
空气污染原因调查人数分布图
从市民和环保人士的不同观点上分析,你认为造成启东市空气污染的主要有害成分是
(用化学式表示)
⑵空气污染形成酸雨。研究性学习小组对启东市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是 ,通过计算得到的结论是 (以定量描述)
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是
(填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
试题篮
()