A、B、C、D四种元素均为短周期元素,A的最外层电子数为B最外层电子数的2倍,C的最高正价与最低负价的绝对值之差为2,A、B两元素形成的物质具有两性,C的最高价氧化物对应的水化物是强酸,D的最高价氧化物对应的水化物的碱性是短周期中碱性最强的,则:
(1)A的气态氢化物的电子式为 B离子的离子结构示意图为
(2)D的最高价氧化物对应的水化物的化学式为 ,含有 键和
键。
(3)C单质的结构式 。
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,C是家庭中常用的一种调味品的主要成分,D是具有果香气味的物质。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)A、B、C中含有的官能团分别是 , , (写名称)
(2)写出反应的化学方程式
A→B:
反应类型:
B+C→D:
反应类型:
(3)B在Cu作催化剂的情况下可催化氧化,其方程式为
(1)某烷烃含有200个氢原子,那么该饱和烃的分子式是 。
(2)辛烷的分子式为 。
(3)A~D是几种烃分子的球棍模型,据此回答下列问题:



A B C D
则:C的结构简式为 。与B、C互为同分异构体的另一有机物的结构简式为
(共11分)如图为某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略。)
按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气……
(1)这三步操作的先后顺序依次是 。
(2)简要说明排空气的方法和证明空气已排尽的方法 。
(3)B装置所起的作用是 。
(4)若对E装置中的混和物再按以下流程实验:
①分离操作I、II的方法是:I ,II 。
②Na2SO3溶液的作用是(用离子方程式表示)
。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)=
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室用无水乙醇与乙酸制备乙酸乙酯的化学方程式如下:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 |
饱和碳酸钠溶液 |
5.0 |
| B |
3mL乙醇、2mL乙酸 |
0.1 |
|
| C |
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 |
1.2 |
|
| D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
②分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) =  ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
| 编号 |
反应速率表达式的定义 |
反应速率表达式 |
反应速率单位 |
| ① |
单位时间内H+浓度的变化量 |
V(H+) = |
mol / L.min |
| ② |
丁 |
戊 |
己 |
| ③ |
单位时间内生成H2标况下的体积 |
V(H2) = 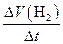 |
L / min |
(3)该学习小组选用0.1 mol Zn和200 mL 1mol/L 稀硫酸(硫酸过量)在250C反应进行研究,用秒表计时,至锌块完全溶解且溶液中不再有气泡放出时,记录反应时间为5分钟,该反应速率V(H+) =
(4)该小组对“影响反应速率的因素”进行了分析,设计如下系列实验,庚辛壬癸四处空白。
| 编号 |
锌的形状 |
锌的规格 |
硫酸的浓度 |
反应温度 |
实验设计的目的 |
| ① |
块状 |
纯锌 |
1mol/L |
250C |
实验①和②研究的目的是 庚 ; 实验②和③研究硫酸浓度对反应速率影响; 实验③和④研究锌的规格对反应速率影响; 实验④和⑤研究的目的是 癸 ; |
| ② |
颗粒状 |
纯锌 |
1mol/L |
250C |
|
| ③ |
颗粒状 |
纯锌 |
辛 |
250C |
|
| ④ |
颗粒状 |
壬 |
2mol/L |
250C |
|
| ⑤ |
颗粒状 |
粗锌 |
2mol/L |
350C |
|
| …… |
镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是 镁原子电子式
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是 (不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg > Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④通过观察某种实验现象得到结论,该实验现象是
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg > Al”
甲试管现象
乙试管离子方程式
实验三:利用原电池原理也可得出“金属性:Mg > Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg >Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
化学世界奥妙无穷,物质之间的反应更是神秘莫测,善于透过现象看本质是学习化学、研究物质性质的基本能力。请我们一起进行探索。
(1)课堂上化学老师将干燥的氯气依次通过干燥红布条和潮湿的红布条,结果:干燥红布条无明显变化,而潮湿的红布条褪色。
①某学生立即发言:结论一、 ,
结论二、氯气与水反应生成的次氯酸具有漂白性。
②老师提示说:还需要补充一个实验才能得知结论二,该实验是
③请写出氯气与水反应的离子方程式
(2)某实验小组用铜和浓硝酸反应制备NO2,并收集一试管NO2气体,将集气瓶倒置于水槽中,并轻微振荡,发现一些典型现象,并对此现象进行探究。
①请写出NO2与水反应化学方程式,并用单线桥表示电子转移方向和数目
②该小组成员积极探讨,得出结论,NO2与水一定发生了化学反应,并设计了两个实验操作对产物进行了验证,得出产物是NO 和HNO3。请填写下表中的甲、乙、丙三处。
| 实验操作 |
实验现象 |
实验结论 |
| 用玻璃片将水槽中的试管口盖住,轻轻将试管取出 |
试管内约有2/3体积的水溶液,且无色 |
NO2与水发生了化学反应,而不是溶于水 |
| 将试管正立,取下玻璃片 |
甲 |
NO2和水反应生成了NO气体 |
| 乙 |
丙 |
NO2和水反应生成了硝酸 |
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯有关性质如下:
| 分子式 |
别名 |
熔点 |
沸点 |
溶解性 |
性状 |
| ClNO |
氯化亚硝酰 |
-64.5℃ |
-5.5℃ |
溶于浓硫酸 |
红褐色液体或有毒气体,具有刺激恶臭,遇水反应生成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯性质拟在通风橱中制取亚硝酰氯,设计了如图所示实验装置。实验开始前K2处于打开状态,K1、K3均已关闭。、
试回答下列问题:
(1)①若D中装有纯净的NO气体,则B中应选用的试剂为 。实验时利用B除去某些杂质气体并通过观察B中的气泡来判断反应速率,B还具有的作用是 ;②若D中装有纯净的氯气,则C中应选用的试剂为 。
(2)装置F的作用是 ;装置G的作用是 。
(3)若无装置G,则F中ClNO可能发生反应的化学方程式为 。
(4)某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO,所以装置H不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是 。
某研究性学习小组用右图所示装置进行下列实验,请回答:
(1)若a中为浓H2SO4,b中为Na2SO3,c中为品
红溶液。先打开活塞K,从分液漏斗放出部分
溶液至烧瓶中,反应一段时间后,可观察到c
中的现象是 ,b中反应停止再关闭K,
向烧杯d中加入沸水,可观察到c中的现象是
;
(2)烧瓶中发生反应的化学方程式为 ;
(3)若实验室用上述装置制取氧气,则b中的试剂
为(填化学式) ,a中的试剂
是 ,反应的化学方程式为 。
为了测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验:
(1)将仪器连接好以后,必须进行的第一步操作是 ;
(2)装置B的作用是  ;
;
(3)已知装置C中装有品红溶液, 其作用是 ;
其作用是 ;
(4)实验室中备有以下常用试剂:a.浓硫酸 b. 品红溶液 c. 酸性高锰酸钾溶液
d. 饱和碳酸氢钠溶液 e. 氢氧化钠溶液 f. 无水硫酸铜 g. 碱石灰
请将下列装置中应盛放的试剂的序号填在横线上:
B中应盛放 ,D中应盛放 ,F中应盛放 ;
(5)若装置E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为 。
现在V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中V的一种原子的原子核内没有中子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍,Y元素原子最外层电子数是X元素原子最外层电子数的两倍;X、Z是金属元素,Z的核外电子排布与Ar原子相同。请回答:
(1)V是 ,X是 ,Z是 (填元素符号)
(2)Y在周期表中的位置是 ;
(3)V和W形成V2W型化合物的电子式为 ,所含的化学键类型为 ;
(4)用电子式表示Z和Y形成化合物的过程是 。
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素符号:B ,C ;
(2)画出A2-的离子结构示意图: ,
指出D在周期表的位置:  ;
;
(3)写出B的呈淡黄色的化合物与CO2反应的化学方程式: ;
(4)比较D的气态氢化物与H2S和HF的稳定性: (用化学式表示);
(5)用电子式表示C与D形成化合物的过程: 。
试题篮
()