为了测定乙醇的分子结构,有人设计了图甲所示的用无水乙醇与钠反应并测定H2的体积的实验装置。回答下列有关问题:
(1)乙醇与钠反应方程式为:__________________________________________________。
(2)按图将仪器装配好,降低C管,使B、C两管间出现15~20cm水位差异后停止。该操作的目的是 。
(3)已知无水乙醇密度为0.789g/mL,现取0.5mL无水乙醇,将0.25mL无水乙醇慢慢推入A中,使之与钠充分反应,则A中至少应加入钠的质量为 。(小数点后保留一位数字)
(4)注射器中吸入0.5mL无水乙醇,将称好的钠放入A中,在将乙醇推入A中之前应该进行的操作是 。
(5)也有人设计了如图乙所示的测定乙醇的分子结构的装置。试分析实验装置甲与实验装置乙相比,优点有 (填出两点即可)。
有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是_____________,无色气泡的成分是___________。
(2)生成红褐色沉淀的原因是____________________________。
(3)写出生成气泡速率明显加快的两个原因________ ____、_________ ____。
(10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):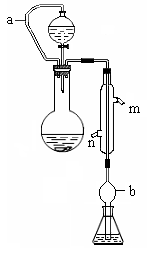
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 |
氢氧化钠溶液的体积 |
|
| 滴定前刻度(mL) |
滴定后刻度(mL) |
|
| 1 |
0.00 |
5. 01 |
| 2 |
6.00 |
10.99 |
| 3 |
12.00 |
17.60 |
(1)写出圆底烧瓶内发生反应的离子方程式 。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是 ; b的作用是
;冷凝管中从(填“n”或“m”) 口进水。
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号) 。
| A.锥形瓶水洗后未烘干 | B.滴定过程中滴定管有漏水现象 |
| C.滴定过程中有少量溶液从锥形瓶中溅出 | D.滴定前滴定管内有气泡,滴定后没有了 |
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是 。
(5)利用题目中所给数据计算肥料中总氮含量为 %(计算结果保留到小数点后1位)。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)上述操作步骤①中错误是 (请指出
具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
(3)步骤②缺少的操作是
(4)某次滴定时的滴定管中的液面如图,其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。

(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
可用图示装置制取少量乙酸乙酯。已知乙酸乙酯的沸点低于乙醇。请填空:
(1)试管a中需加入 浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
(2)为防止a中的液体在实验时 发生暴沸,在加热前应采取的措施是 。[
发生暴沸,在加热前应采取的措施是 。[
(3)实验中加热试管a的目的是:
① ;
② 。
(4)试管b中加有饱和Na2CO3溶液,其作用是 。
(5)试管b中导气管不伸入液面下的原因是 。
、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。
第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2 O2
O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
| 催化剂:MnO2 |
第1组 |
第2组 |
第3组 |
第4组 |
| 前15s产生氧气的量(ml) |
11 |
15 |
8 |
7 |
| 前30s产生氧气的量(ml) |
21 |
24 |
11 |
9 |
| 前45s产生氧气的量(ml) |
31 |
35 |
18 |
12 |
| 前60s产生氧气的量(ml) |
45 |
48 |
26 |
15 |
(1)写出H2O2分解的反应方程式: ;
(2)从实验的几组数据中能得到的是: ;
(3)实验比较反应速率时可以测定相同时间内产生气体的体积,也可测 。
某化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯的化学方程 式 ;
式 ;
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其 理由正确的是 。
理由正确的是 。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙酸,也会使溴水带色
(3)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是 。为验证这一反应是加成反应而不是取代反应,可用pH试纸来测试反应后溶液的酸性,理由是 。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如右图所示装置,则A中的试剂应为 ,其作用是 ,B中的试剂为 。
(5)处理上述实验后烧瓶中废液的正确方法是
A.废液经冷却后倒入下水道中
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.32 |
25.34 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
Ⅰ.为制取较纯净的溴苯和验证反应机理,某化学课外小组设计了实验装置(如右图)。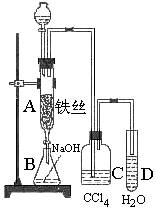
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式
(2)实验结束时,打开A下端的活塞,让反应 液流入B中,充分振荡,目的是
液流入B中,充分振荡,目的是  。
。
(3)C中盛放CCl4的作用是 。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。设计另外一种方案证明之(写出操作、现象及结论)
Ⅱ.含苯酚的工业废水处理的参考方案如下: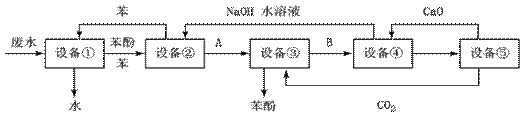
回答下列问题:
(1)设备①进行的是操作____________(填写操作名称),实验室这一步操作所用的仪器是:____________;
(2)由设备②进入设备③的物质A是 ,由设备③进入设备④的物质B是 ;
(3)在设备③中发生反应的化学方程式为_____________________;
(4)在设备④中, 物质B的水溶液和CaO反应,产物是 、 和水,可通过________操作(填写操作名称)分离产物;
(5)上图中,能循环使用的物质是C6H6、CaO、______、______。
现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了鉴别四种溶液各是什么,将它们随意编号为A、B、C、D后,按下表进行实验,产生的现象如下表所示。
试根据实验现象回答:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A+B |
没有现象发生 |
| ② |
B+D |
有气体放出 |
| ③ |
C+B |
有沉淀生成 |
| ④ |
A+D |
有沉淀生成 |
(1)推断并写出各物质的化学式:
A 、B 、C 、 D 。
(2)写出各序号实验中有关反应的离子方程式,不反应的说明理由。
①
②
③
④
有机物A由C、H、O、Cl四种元素组成,其相对分子质量为198.5,Cl在侧链上。当A与Cl2分别在Fe作催化剂和光照条件下以物质的量之比为1:1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与 溶液反应时有气体放出。A经下列反应可逐步生成B~G。
溶液反应时有气体放出。A经下列反应可逐步生成B~G。
(1)A的分子式为________;D的结构简式为_________;
(2)上述反应中属于取代反应的是_________ (填编号);
(3)C中含氧官能团的名称为_______、________;
(4)E的同分异构体中,满足①苯环上只有一个侧链,且侧链上含有一个一CH ;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
________、________、________;
( 5)写化学方程式(有机物写结构简式):
5)写化学方程式(有机物写结构简式):
A与NaOH的醇溶液共热:______; E在一定条件下生成F:______。
某化学兴趣小组欲设计使用如下装置验证:
铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是_________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是______(填化学式),通入该气体的目的是________;进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)若C装置的硬质玻璃管中出现堵塞,则B中可能出现的现象是________;
(4)关闭 、
、 ,打开
,打开 ,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入
,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入 至满。则D中一定发生反应的离子方程式为:_________;
至满。则D中一定发生反应的离子方程式为:_________;
(5)若E中出现倒吸,可采取的应急操作是______;
(12分) 甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:
;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 |
设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 |
|
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油 |
|
(4)通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,大家能设计实验证明吗?
| 实验方法 |
可能观察到的现象和结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。 |
物质的量浓度大的溶液中酚酞红色消失 证明 |
| 方案二:向原红色消失的溶液中加 (填试剂名称) |
红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关 |
某学校设计了一节实验活动课,让学生从废
旧干电池回收碳棒、锌皮、 、
、 、
、 等物质,
等物质,
整个实验过程如下,请回答有关问题。
(1)有关干电池的基本构造和工作原理。右图是干电池的
基本构造图。干电池工作时负极上的电极反应式子是 ,
的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是 。
(2) 锌皮和碳棒的回收。用钳子和剪子开回收的干电池的锌筒,将锌皮和碳棒取出,并用手刷刷洗干净,将电池内的黑色粉末移入小烧杯中。
(3) 氧化铵、氯化锌的提取、检验和分离。
① 如何从黑色粉末中提取 和
和 等晶体的混合物?写出简要的实验步骤。
等晶体的混合物?写出简要的实验步骤。
② 设计简单的实验证明所得晶体中含有 和
和 [一直
[一直 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
有关离子方程式 |
| (a) |
|
|
|
| (b) |
(c) |
说明有 |
(d) |
| (e) |
(f) |
说明有 |
|
(a) ,(b) ,(c) ,(d) ,(e) ,(f) ,
(4)最后剩余的黑色残渣的主要成分是 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。
,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。
太阳能的开发和利用是21世纪的一个重要课题。
(1)利用储能介质储存太阳能的原理是:白天在太阳光照射下,某种盐熔化,吸收热量,晚间熔盐释放出相应能量,从而使室温得以调节。已知如下表数据:
| 盐 |
熔点/℃ |
熔化吸热/ kJ·mol-1 |
参考价格/元·千克-1 |
| CaCl2·6H2O |
29.0 |
37.3 |
780~850 |
| Na2SO4·10H2O |
32.4 |
77.0 |
800~900 |
| Na2HPO4·12H2O |
36.1 |
100.1 |
1 600~2 000 |
| Na2S2O3·5H2O |
48.5 |
49.7 |
1 400~1 800 |
其中最适宜用作储能介质的是___________________。
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
(2)制造太阳能电池需要高纯度的硅,工业上由粗硅制高纯硅常通过以下反应实现:
 关于上述条件下两个反应的叙述中不正确的是______________。
关于上述条件下两个反应的叙述中不正确的是______________。
A.两个反应都是置换反应
B.反应①是放热反应
C.上述反应是可逆反应
D.两个反应都是氧化还原反应、
(3)右图是一种太阳能热水器的示意图,阳光照射到太阳能集热器上,将太阳能转化,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据你对水的密度的认识,你估计阳光照射下水将沿________________(填“顺”或“逆”)时针方向流动。
试题篮
()