(8分)氯气是一种重要的化工原料,在生产和生活中应用十分广泛。
已知: (浓)="==="
(浓)="==="  ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 。(选填A或B或c)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式: 。
(3)实验室收集氯气的方法是 。
(4)常用 溶液吸收氯气防止污染。写出该反应的离子方程式 。
溶液吸收氯气防止污染。写出该反应的离子方程式 。
(10分)为测定某含有杂质Na2O的Na2O2样品的纯度,2个小组分别设计如下方案。首先准确称量样品mg,然后,按照以下方案进行实验,请你完成相关内容:
[方案一]:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量。
(1)Na2O2跟水反应的离子方程式是: ;
(2)根据所给数据计算出的试样中Na2O2含量的代数式为 。
[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
(1)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是 。(填写仪器编号)
(2)装置①⑤的作用分别是:① ⑤ 。
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示:
(1)装置A中还应安装的玻璃仪器是____,装置B用冰水浴的原因是________.
(2)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:________________.
(3)①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式:_____________________________。
②饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a.____________________;b________________________;c.洗涤;d.干燥。
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是______________。
已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸。
(1)请写出碘元素在周期表的位置:第五周期 族。
(2)将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能
有 气体。
(3)小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究。他设计了如右实验装置图初步探究设计:
①其中直形玻璃管中所装的药品是 (写名称)
②足量四氯化碳的两个作用是: , 。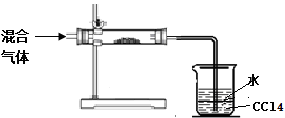
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2。
③小明拟对溶在水层的其它混合气体成分做进一步探究。请你从以下限选试剂中选择合适的试剂帮小明完成实验报告。
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1mol/L HNO3、淀粉溶液、BaCl2溶液
| 实验方案 |
可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 |
|
| |
|
| |
|
(本题共11分)
某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
34.装置的连接顺序为a→ → → → →b→c→f。
35.硬质玻璃管中可观察到的现象是 。
硬质玻璃管与收集器之间没有用导管连接,原因是 。
反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
36.试剂X的化学式为 ;有同学分析淡黄色溶液中含有Fe2+,你认为 (填“合理”或“不合理”);固体产物的成分可能为 (填相应的字母);
| A.Fe和FeCl3 |
| B.FeCl2和FeCl3 |
| C.Fe、FeCl2和FeCl3 |
| D.Fe和FeCl2 |
37.加入少许植物油的作用是 ,用离子方程式表示加入新制氯水后溶液红色加深的原因 。
38.某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因 ,
请设计实验对你所分析的原因进行验证,简要写出实验方案 。
(1)下列实验操作中,错误的是_____________(填序号,下同)
①用10mL量筒量取6.4 mL盐酸;
②切割金属钠时,将残留物放入废物缸中;
③配制FeSO4溶液时一般要加入适量铁屑;
④配制一定物质的量浓度的溶液定容时仰视读数会使所配溶液浓度偏高;
⑤不慎接触过多的氨,应及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3;
⑦稀释浓硫酸时应把水倒入浓硫酸中。
(2)下图为实验室制H2的装置。若液面刚好不与锌粒接触而又无酸液可加入,则可以从长颈漏斗中加入适量试剂是__________________
①食盐水 ②苯 ③四氯化碳
④Na2CO3溶液 ⑤硫酸铜溶液 ⑥KNO3溶液
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→ → → → →g→h→d(填导管接口字母)。
(3)证明SO2具有氧化性的现象是 ;证明SO2具有还原性的实验中,反应的离子方程式是 。
(4)C试管中NaOH溶液的作用是 ,CCl4的作用是 。
下列关于应用套管实验装置(部分装置未画出)进行的实验,叙述错误的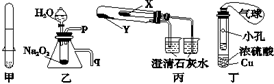
| A.利用甲装置可以制取少量H2 |
| B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量 |
| C.利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3 |
| D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液 |
(12分)如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:

|
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
(1)试管C口部的棉团上(碱过量)发生反应的离子方程式是
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液(过量),则发生反应的化学方程式是 。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是 (写两种)
下图装置Ⅰ是实验室制乙酸乙酯的常用装置:

实验中所用的某些试剂及产物的相关数据如下:
| 物 质 |
熔点/℃ |
沸点/℃ |
||
| 乙 醇 |
-114 |
78 |
||
| 乙 酸 |
16.6 |
117.9 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
||
| 98%H2SO4 |
10 |
338 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式 ,浓H2SO4的作用是 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振荡,静置, (填现象),然后将产物从__ __口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
(10分)将5.6 g Fe加入到100 mL的稀硫酸中溶液中,恰好完全反应。
(1)写出该反应的化学方程式,并标出电子转移方向和数目。
(2)试求生成气体在标准状况下的体积和稀硫酸的物质的量浓度。
(3)计算反应中转移的电子数目。
(10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol・L-1的盐酸和0.1mol・L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol・L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol・L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol・L-1盐酸和0.1mol・L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
| A.50mL、50mL | B.100mL、100mL |
| C.100mL、150mL | D.250mL、250mL |
(4)写出有关的化学方程式_____________________ 。
某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(3)判断到达滴定终点的实验现象是 。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是____________________,其中发生反应的化学方程式为_________________________________。
(2)实验过程中,装置B中发生的现象是 ,说明SO2 具有 性;
装置C中发生的现象是 ,说明 SO2 具有 性;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:______________;
(4)尾气可采用 溶液吸收。
试题篮
()