工业上高温煅烧石灰石(主要成分是碳酸钙)可制得生石灰(氧化钙)和二氧化碳。小明同学为了分析一批石灰石的纯度,在实验室中取此样品44g,充分煅烧后剩余固体26.4g(杂质不参加反应)。计算:
(1)生成二氧化碳的质量为 。
(2)该样品中石灰石的纯度是多少?(计算结果精确到0.1%)
氢氧化镁[Mg(OH)2]是一种固体阻燃剂,在加热条件下分解为氧化镁和水。
(1)根据化学方程式计算,5.8g氢氧化镁完全反应,理论上生成氧化镁的质量。
(2)现将5.8g氢氧化镁加热一段时间后,测得剩余干燥的固体中氧元素的质量为2.4g。计算已反应的氢氧化镁的质量。
某兴趣小组在实验室里做制取氢气的实验,取6.5g锌和93.7g稀硫酸放入同一烧杯中,恰好完全反应。请计算:(写出计算过程)
(1)生成氢气的质量
(2)反应后所得溶液中溶质的质量分数。
取6.5g锌粉于烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸154.7g。请计算反应后所得溶液中溶质的质量分数。
小明同学欲测定某纯碱样品(含少量氯化钠)中碳酸钠的质量分数,取26.5g该纯碱样品加入到100g水中,使其完全溶解,再加入169.3g稀盐酸,恰好完全反应,得到287g不饱和溶液。请计算:
(1)纯碱样品中碳酸钠的质量分数
(2)反应后得到的不饱和溶液中溶质的质量分数。
金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
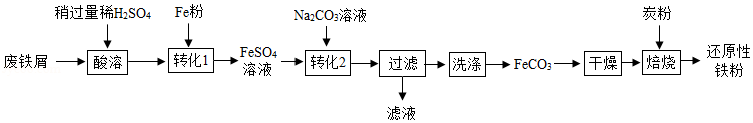
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
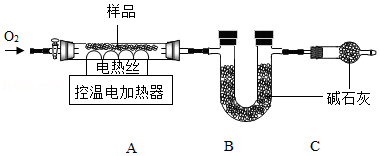
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
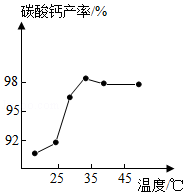
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 (4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)
人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明他们的化学性质都 。
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是 。
②近代工业上采用电解熔融氧化铝(A12O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为 : 。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17All2是特殊的储氢材料,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为 。
(4)钛和钛合金是21世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其 (填字母序号)非常好。
A.可塑性 B.机械性能 C.抗腐蚀性能
(5)铁在潮湿的空气中反应生成疏松的铁锈。已知:2FeCl3+Fe=3FeC12
①铁锈的主要成分是 (填化学式):将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及 种化学反应基本类型。
②将10g表面生锈的铁钉(杂质已忽略)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为3.6g。则原锈铁钉中铁元素的质量分数为 。
(6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有 (填字母序号)。
A.金属原料的成本 B.生成过程中的能耗和污染 C.金属的回收利用
有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20g和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤,干燥后称得其质量为13.5g。该样品中铜的质量分数为 。
(2)再取三份不同质量的样品,分别加入到三份100g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
| 实验序号 |
① |
② |
③ |
| 样品的质量/g |
10 |
20 |
30 |
| 生成气体的质量/g |
0.1 |
0.2 |
0.25 |
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
| |
第一次 |
第二次 |
第三次 |
| 加入稀硫酸的体积(mL) |
15 |
15 |
15 |
| 生成氢气的质量(g) |
m |
0.04 |
0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是少?(写出计算过程)
水产养殖的速效增氧剂“鱼浮灵”的主要成分是过氧碳酸钠(aNa2CO3•bH2O2)。
某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
【查阅资料】①过氧碳酸钠有Na2CO3和H2O2的双重性质;50℃开始分解。
②过氧碳酸钠在异丙醇(有机溶剂)中的溶解度较低。
Ⅰ.“鱼浮灵”的制备。
实验室用Na2CO3与稳定剂的混合溶液和30%的H2O2溶液反应制备过氧碳酸钠,实验装置如图所示。

(1)反应温度不能超过20℃的原因是 。
(2)反应结束后,停止搅拌,向反应液中加入异丙醇,静置过滤、洗涤、干燥,获得过氧碳酸钠固体。加入异丙醇的目的 。
Ⅱ.“鱼浮灵”的成分测定。
【定性检测】检测过氧碳酸钠溶液中的成分。
(3)请补充完成下列实验报告中的相关内容。
实验序号 |
实验步骤 |
实验现象 |
解释或结论 |
① |
取样,加入MnO2粉末,用带火星的木条伸入试管内 |
木条复燃 |
反应的化学方程式
|
② |
|
|
溶液中含有Na2CO3 |
【定量研究】测定“鱼浮灵”中过氧碳酸钠的组成。
实验③:称取一定质量的“鱼浮灵”样品于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液,过滤、洗涤、干燥,得到碳酸钡(BaCO3)固体3.94g。
实验④:另称取相同质量的“鱼浮灵”样品于锥形瓶中,加入足量稀硫酸,再逐滴加入高锰酸钾溶液,充分反应,消耗KMnO4的质量为1.896g,该反应的原理是:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O。
(4)计算确定过氧碳酸钠(aNa2CO3•bH2O2)的化学式(写出计算过程)。
Ⅲ.“鱼浮灵”的增氧原理。
研究小组通过测定常温下相同时间内水溶液中溶解氧的变化,探究CO32﹣、OH﹣对H2O2分解速率的影响,设计了对比实验,实验数据记录如下表。
编号 |
① |
② |
③ |
④ |
⑤ |
试剂 |
H2O |
4%H2O2溶液 |
Na2CO3固体 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
NaOH溶液 4%H2O2溶液 |
pH |
6.96 |
6.01 |
8.14 |
8.15 |
9.26 |
溶解氧 (mg•L﹣1) |
5.68 |
6.44 |
9.11 |
9.12 |
10.97 |
(5)由实验②可知,常温下,过氧化氢水溶液呈 (填“酸性”“中性”或“碱性”)。
(6)过氧碳酸钠可以速效增氧的原理是 。
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。

(1)1766年,英国化学家卡文迪许用锌和稀硫酸制得“可燃空气”,他所说的“可燃空气”成分是 (填化学式)。“可燃空气”在纯氧中燃烧生成水,可得出“水是一个结合物而不是简单元素”。
(2)1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁,实验示意图如图1所示。上述反应的化学方程式为 。该反应若生成1g氢气,则理论上铁制枪管应增重 g。
实验发现枪管实际增重比理论数值大,其可能的原因是 。
(3)1800年,英国化学家尼科尔森通过电解水得到氢气和氧气,后人不断研究和改进该实验。现有某同学在水电解器中加入含酚酞的稀Na2SO4溶液,至充满管A和管B(Na2SO4溶液呈中性且不参与反应)。通直流电一段时间后现象如图2所示。电解结束后将容器内所有液体倒入烧杯中,溶液呈无色。
①下列说法正确的是 (填字母)。
a.硫酸钠在水中形成自由移动的Na+和SO42﹣,可增强水的导电性
b.电解过程中化学能转化为电能
c.电极N与电源负极相连
②电解后,管A中生成的微粒有 (填微粒符号)。
(4)当温度、压强分别超过临界温度(374.2℃)和临界压强(22.1MPa)时的水称为超临界水。现代研究表明:超临界水能够与氧气以任意比例互溶,由此发展了超临界水氧化技术。550℃时,测得乙醇(C2H6O)的超临界水氧化结果如图3所示。

注:δ(分布分数)表示某物质分子数占所有含碳物质分子总数的比例。
如δ(CO)
图中CO的分布分数先增后降的原因是 、 。
二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加SO2可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量≤259mg/L。
(1)SO2作为食品添加剂须严格控制用量的原因是 。
(2)为检测某国产葡萄酒SO2中的含量是否符合国家标准,进行如下实验:
步骤1 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(该指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈 色。
②向10g 30%的H2O2溶液中加入 g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
某课外兴趣小组的同学对二氧化碳的制取和性质进行相关探究。

【实验回顾】
(1)实验室用大理石与稀盐酸制取二氧化碳的化学方程式为 。用向上排空气法收集二氧化碳的原因是 。
【实验探究】
(2)如图1所示,打开汽水瓶盖,有大量气泡冒出,塞上带导管的橡皮塞,导管另一端伸入装有滴加了紫色石蕊溶液的蒸馏水的试管中,轻轻振荡汽水瓶,观察到紫色石蕊溶液变红;加热上述试管,发现溶液颜色由红色变为紫色,写出上述变化过程中反应的化学方程式 , 。
(3)打开汽水瓶盖时,有大量气泡冒出,说明气体的溶解度随 。
(4)如图2所示,在C处放入用石蕊溶液染成紫色的干燥的纸花完成以下实验:
在A处持续而缓缓地通入气体X.当关闭K时,C处的紫色石蕊纸花不变色;当打开K后,C处的紫色石蕊纸花变为红色。
若气体X为未经干燥的二氧化碳,则B瓶中盛放的溶液可以为 (填字母)。
若气体X为未经干燥且混有氯化氢的二氧化碳,则B瓶中盛放的溶液可以为 (填字母)。
A.浓硫酸
B.氢氧化钠溶液
C.饱和碳酸氢钠溶液
【交流反思】
(5)该小组用空气样品和提高二氧化碳含量的空气的样品,控制相同条件测定二者在光照前后温度的变化,实验结果如图3.则与空气样品对应的温度变化曲线是 (填"a"或"b"),二氧化碳可以产生温室效应。

请简述温室效应对人类生存环境的功与过: (各写一点)。
试题篮
()