某学习小组在实验室中用加热KClO 3和MnO 2混合物的方法制取O 2,反应过程中固体质量变化如图所示,请计算。
(1)制取O 2的质量是 g。
(2)原混合物中KClO 3的质量分数。(写出计算过程,计算结果精确到0.1%)

碳酸氢铵(化学式NH 4HCO 3)是农业生产中常用的铵态氮肥。
(1)①碳酸氢铵中氮、氢、碳、氧四种元素的最简质量比为 ;
② g碳酸氢铵中含4.8g氧元素。
(2)将15.8g碳酸氢铵加入到盛有100g稀盐酸的烧杯中,恰好完全反应。求反应后所得溶液的溶质质量分数。(写出计算步骤)
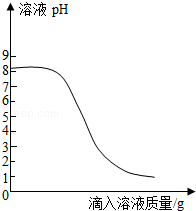
某化学兴趣小组对胃药"碳酸氢钠片"进行了探究,具体做法如下:
Ⅰ.取1片胃药研碎,加水完全溶解得到100g溶液;
Ⅱ.配制100g 0.365%的稀盐酸作为模拟胃酸;
Ⅲ.取上述一种溶液20g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如图所示。
请回答下列问题:
(1)碳酸氢钠属于 (填"酸""碱"或"盐");
(2)步骤Ⅲ中,当滴入另一种溶液的质量为10g时,锥形瓶内物质恰好完全反应(胃药中其它成分不参加反应),请根据实验数据计算每片胃药中碳酸氢钠的质量,写出必要的计算过程。
将25.6gNaCl和MgCl 2固体混合物完全溶于126g水中配成溶液,再将200g一定溶质质量分数的NaOH溶液不断加入到该溶液中,充分反应后,测得的实验数据如表.
| 实验次数 |
1 |
2 |
3 |
4 |
5 |
| 加入NaOH溶液质量/g |
40 |
40 |
40 |
40 |
40 |
| 共生成沉淀的质量/g |
2.9 |
5.8 |
m |
11.6 |
11.6 |
求:(1)如表中m的值为
(2)恰好完全反应时,所得溶液中溶质的质量分数.
实验室用含杂质的锌与稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g。计算:
(1)杂质的质量 g。
(2)反应后所得溶液的溶质质量分数(请写出计算过程)
碳酸氢铵(化学式NH 4HCO 3)是农业生产中常用的铵态氮肥。
(1)①碳酸氢铵中氮、氢、碳、氧四种元素的最简质量比为 ;
② g碳酸氢铵中含4.8g氧元素。
(2)将15.8g碳酸氢铵加入到盛有100g稀盐酸的烧杯中,恰好完全反应。求反应后所得溶液的溶质质量分数。(写出计算步骤)
取4.4g部分被氧化的镁带样品,加入到147g溶质质量分数为10%的H 2SO 4溶液中,镁带和H 2SO 4均恰好完成反应.
(1)写出上述镁带在H 2SO 4溶液中发生反应的化学方程式 .
(2)反应完成后生成MgSO 4的质量为 g.
(3)该镁带样品中MgO的质量为 g.其中未被氧化与已被氧化的镁元素的质量比为 .
(4)若生成的MgSO 4溶液是不饱和溶液,求该溶液的质量为多少(写出计算过程)?
将氯化钠与碳酸钠的混合物15.0g,溶于100mL水中,向所得溶液中滴加5.55%的氯化钙溶液至完全反应,如图是所加氯化钙溶液与生成沉淀质量关系图,求恰好完全反应时:
(1)原混合物中,碳酸钠的质量.
(2)所得溶液中,溶质质量分数.(计算结果精确至0.1%)

取8.0g铝土矿(主要成分是Al 2O 3),溶于128.4g稀盐酸中,盐酸恰好完全反应.经过滤、干燥后,得到滤渣2.9g,(假定铝土矿样品中所含的杂质不溶于盐酸).
(1)求铝土矿的纯度 %.
(2)求所得溶液的溶质的质量分数(写出计算过程).
化学兴趣小组的同学在探究碱的化学性质时,完成了如图1所示的两个实验。实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色。请你完成下列问题:
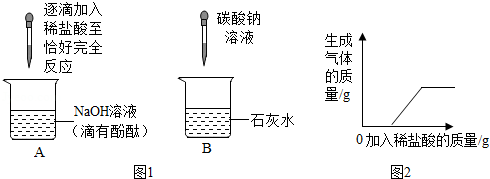
(1)A实验中发生反应的现象为 。
(2)B实验中发生反应的化学方程式是 。
(3)【提出问题】废液中,能使酚酞溶液变红的物质可能是哪些呢?
【作出猜想】猜想一:废液中,能使酚酞溶液变红的物质可能是NaOH;
猜想二:废液中,能使酚酞试液变红的物质还可能是 ;
猜想三:废液中,能使酚酞溶液变红的物质还可能是Ca(OH)2。
【实验验证】同学们对可能含有的碱性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到如图2所示的图象。
【结论】分析图象数据得出,废液中使酚酞变红的物质一定是 ,一定不是 。
【拓展提高】为了使以上废液实现安全排放,你的做法是 。
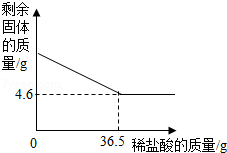
牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏对牙齿的摩擦作用和去污效果,牙膏摩擦剂一般由①CaHPO 4②CaCO 3③Al(OH) 3④SiO 2中的一种或几种组成。
(1)根据上述信息,推测牙膏中的摩擦剂应具备的性质有 (填序号)。
①易溶于水②难溶于水③坚硬④柔软⑤颗粒较大⑥颗粒较小
(2)已知某品牌牙膏中的摩擦剂是CaCO 3和SiO 2(不与稀盐酸反应)中的一种或两种物质,将适量的该牙膏溶于水、静置后过滤,向所得固体中加入足量稀盐酸,观察到的实验现象是 ,则证明该牙膏中的摩擦剂是CaCO 3和SiO 2的混合物。
(3)取20g该牙膏样品充分溶解、静置、过滤,用10%的稀盐酸测定得到的固体成分。测定过程中,剩余固体和加入稀盐酸的质量分别如图所示,试计算该牙膏中摩擦剂的质量分数是多少?
冬天饶老师配值了一瓶澄清石灰水,到了夏天石灰水变浑浊了,瓶壁和瓶底出现了少量白色固体,同学们就此白色固体的成分探究如下:
(1)猜想:①可能含有碳酸钙,生成碳酸钙的化学方程式为 .
②可能含有的另一种物质是 ,出现该物质的原因可能是温度升高,该物质的溶解度减小,结晶析出.
(2)同学们通过实验证明了猜想②中物质的存在,请你也设计一个实验予以证明.
某碳酸钾样品中混有少量氯化钾杂质,取一定量样品于烧杯中,向烧杯中加入100g质量分数为7.3%的稀盐酸,此时恰好完全反应,将所得溶液蒸干得到18.1g固体,计算样品中碳酸钾的质量分数?(计算结果精确到0.1%)
取10g氢氧化钠溶液于烧杯中,向其中加入10g溶质质量分数为9.8%的稀硫酸恰好完全反应。请计算:
反应后所得溶液的溶质质量分数。(计算结果精确到0.1%)
加热碳酸氢铵时闻到了刺激性气味,引起了同学们对氨气的兴趣,决定对其进行探究。
(一)探究性质与变化
【实验方案】如图所示
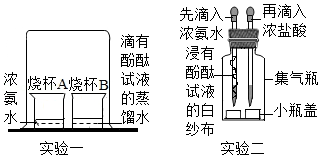
【实验现象】
(1)实验一中的现象是 。
(2)实验二中先滴入浓氨水,一段时间后,再滴入浓盐酸。滴入浓盐酸后观察到的现象是:①集气瓶中从下至上出现白烟,② (写一点)。
【实验结论】
(3)微观上,说明微粒具有的性质是 。宏观上,从物质的性质或变化的角度分析,你得出的结论是 (写一点)。
【反思与评价】
(4)实验二避免了实验一的不足,改进后的优点有 (写一点)。
(二)验证氨气中氮、氢两种元素的质量比
【查阅资料】
(5)氨气在加热条件下能与氧化铜反应:2NH3+3CuO 3X+N2+3H2O,X的化学式是 。
3X+N2+3H2O,X的化学式是 。
【设计方案】如图所示:(假定氮气被完全吸收)

【数据处理与误差分析】
充分反应后,测得A、B、C三个装置在反应前后的质量变化如下表所示
装置 |
A |
B |
C |
数据 |
减少了4.8g |
增加了6.0g |
增加了2.8g |
(6)甲同学利用A、B、C三组装置所提供的数据,乙同学利用B、C两组装置所提供的数据,计算出的氮、氢元素的质量比都与理论值明显不符,分析产生误差的原因是 。
(7)若用A、C两组装置所提供的数据计算,与理论值是否相符?写出简单的计算过程证明你的结论 。
(三)探究用途与制法
(8)在一定条件下,可用氮气和氢气制得氨气。工业上常用氨气生产氮肥(NH4)2SO4,施肥时,要避免与之混用的是 (填序号)。
A.硝酸钾 B.草木灰(主要成分是K2CO3)
C.熟石灰 D.氯化钾
(9)工业上生产的(NH4)2SO4中常常混有少量KCl,检验其是否含有KCl的操作方法是 。
附:部分碱、酸、盐的溶解性表(20℃)
阴离子/阳离子 |
OH﹣ |
NO3﹣ |
Cl﹣ |
SO42﹣ |
H+ |
溶、挥 |
溶、挥 |
溶 |
|
K+ |
溶 |
溶 |
溶 |
溶 |
NH4+ |
溶、挥 |
溶 |
溶 |
溶 |
Ba2+ |
溶 |
溶 |
溶 |
不 |
Ag+ |
﹣ |
溶 |
不 |
微 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“﹣”表示那种物质不存在或遇到水就分解了。
试题篮
()