请根据下图回答问题:

① 将图1和图6连接可以制取氧气,反应的化学方程式为 ,证明氧气已经集满的现象是 。若用图6收集一瓶含1/4空气的氧气,操作的方法是 。
② 图2中仪器A的名称为 ,它在装置中的主要作用是 。甲同学用图2和图 连接来制取二氧化碳,装置中加入盐酸的量至少要 。
③ 乙同学在图2基础上增加了一块带孔的隔板(如图3),则大理石应放在 处(填“a”或“b”),该装置中加入盐酸的量至少要 ;若加入盐酸过多,则有可能产生的后果是 ,要使反应停止,其操作是 。
④ 丙同学用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。反应前他事先往试管中加入了少量的水,甲同学由此产生了疑问,提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓。
猜想2:……
甲同学根据猜想进行了实验:每次取15mL 15%的过氧化氢溶液,稀释成不同溶质
质量分数,在其他条件相同的情况下进行实验。记录数据如下:
| 实 验 |
1 |
2 |
3 |
4 |
5 |
| 过氧化氢溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
| MnO2粉末用量/g |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 收集到500mL气体时所用时间/s |
560 |
186 |
103 |
35 |
12 |
| 反应后液体温度/℃ |
26 |
38 |
43 |
59 |
71 |
根据表中数据可知:过氧化氢溶液的溶质质量分数对反应速度的影响是 。
甲同学的猜想2是:加水可以 。
如图是甲、乙、丙三种固体物质的溶解度曲线。

① P点的含义 。
② 要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种)。当甲溶液中含有少量乙时,可采用 的方法提纯甲。
③ t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为 (精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是 。
Ⅰ.溶质的质量 Ⅱ.溶剂的质量 Ⅲ.溶质的质量分数
④ t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是 。
一定质量的木炭在氧气和氮气的混合气体的密闭容器中燃烧产生CO和CO2,且反应后测得混合气体中碳元素的质量分数为24%,则其中氮气的质量分数不可能为
| A.10% | B.20% | C.30% | D.40% |
将一定量的乙醇(C2H5OH)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:( )
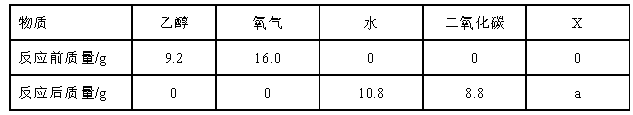
| A.无论如何改变氧气的起始量,均有X 生成 |
| B.X 一定是该反应的催化剂 |
| C.X 不含氢元素 |
| D.表中a 的值为6.6 |
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分。探究过程如下:
(1)提出假设:气体产物全部是CO2。
(2)查阅资料:a.氮气不能与炭粉及Fe2O3反应。
b.高温下可以发生下列反应:2Fe2O3+3C 4Fe+3CO2↑ C+CO2
4Fe+3CO2↑ C+CO2 2CO
2CO
(3)设计方案:将一定量氧化铁在隔绝空气的环境下与过量炭粉充分反应。用实验中实际测得产生气体的质量,与理论计算得到的CO2的质量进行比较。
(4)实验装置:如右图所示。

(5)实验操作:
①称量:反应前Fe2O3的质量3.20 g;炭粉的质量2.00g;玻璃管C的质量48.48 g。反应后玻璃管与残留固体共52.24 g。
②加热前先通一段时间氮气,再夹紧弹簧夹T,点燃酒精喷灯加热。
(6)问题分析:①用酒精喷灯而不用酒精灯的目的是 。
②加热前先通一段时间氮气的目的是 。
③理论计算:若氧化铁与炭粉反应的气体产物全部是CO2,求3.20 g氧化铁完全反应时生成CO2的质量。(写出计算过程)
④根据实验数据计算实验中实际获得气体的质量。(写出计算过程)
(7)结论:原假设 (能、不能)成立,理由是 。
(8)兴趣小组成员小聪想到家里新换的水龙头。他从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你参与。
【作出猜想】
猜想1:Cr>Fe>Cu; 猜想2:Fe>Cu >Cr; 猜想3:你的猜想是 。
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验 操作 |
 |
 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
铜表面无气泡 |
【结论与解释】
①小聪得到的结论是猜想 正确。
②实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出化学方程式 。
天然气的主要成分是甲烷(CH4),化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,请你参与探究与分析:
【提出问题】甲烷在氧气中燃烧后生成哪些物质?
【知识储备】含碳元素的物质在氧气中完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝色。
【猜想与假设】
| 产 物 猜 想 |
甲 |
乙 |
丙 |
丁 |
| CO2、H2O |
CO、H2O |
NH3、CO2、H2O |
CO2、CO、H2O |
你认为 同学的猜想是错误的,理由是 。
【实验探究】为了验证上述猜想与假设,将甲烷在一定量的氧气中燃烧的产物依次通过下列装置:
 [
[
① A、B装置的顺序 (填“能”或“不能”)颠倒。
②实验中用纯净氧气而不用空气的原因是 。
③实验中观察到A中无水CuSO4粉末由白色变为蓝色,B、D中澄清石灰水变浑浊,C中黑色粉末变成光亮的红色,由此推断 同学猜想成立。
④请写出B中澄清石灰水变浑浊、C中黑色粉末变成红色的化学方程式: 、 。
【反思与交流】为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件
是 。
如图所示,两只U型管中分别加入纯净、等质量的铝粉和铁粉,同时将两端注射器内的液体(等质量、浓度为20%的稀硫酸)快速注入U型管中。
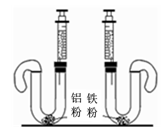
(1)写出铁粉与稀硫酸发生反应的化学方程式 。
(2)反应结束并冷却至室温,发现左端气球膨胀程度明显大于右端,若仅有一只U型管内的硫酸有剩余,则是 (填“左”或“右”)端的U型管。
(3)若将铝粉和稀硫酸换成其他两种化合物(或其溶液),也能观察到气球明显膨胀,这两种物质可能是(写化学式) 。
铁是应用最广泛的金属.新型材料纳米级Fe粉能用作高效催化剂.实验室采用还原法制备纳米级Fe粉,其流程如图所示:
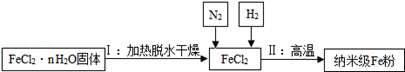
(1)纳米级Fe粉在空气中易自燃.实验中通入N2的目的是 。
(2)写出Ⅱ中H2还原FeCl2得到铁的化学方程式 ,该反应属于基本反应类型中的 反应。
某工业盐酸中因含有少量FeCl3(不含其它杂质)而显黄色,测知该盐酸中H+和Cl—的个数比为88∶97,则其中Fe3+和Cl-的个数比为
| A.1∶97 | B. 1∶3 | C. 3∶1 | D.3∶97 |
下列图像不能正确反映其对应变化关系的是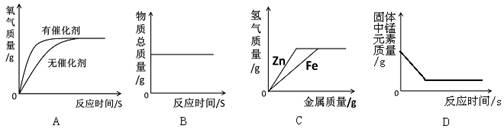
| A.用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气 |
| B.一定质量的红磷在密闭容器中燃烧 |
| C.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 |
| D.加热一定量高锰酸钾制氧气 |
如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是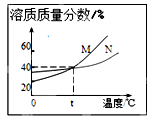
| A.M、N两溶液的溶质质量分数相等 |
| B.只有N析出晶体 |
| C.M、N均有晶体析出 |
| D.M、N两溶液都是饱和溶液。 |
为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表
| 物质 |
丙烷 |
氧气 |
水 |
二氧化碳 |
X |
| 反应前质量/g |
4.4 |
12.8 |
0 |
0 |
0 |
| 反应后质量/g |
0 |
0 |
7.2 |
4.4 |
a |
下列判断正确的是
A.X可能含有氢元素 B.X可能是该反应的催化剂
C.表中a的值为5.6 D.X只含碳元素
百合具有润肺止咳、养颜美容等功效,百合中含有秋水仙碱,其化学式为C22H25NO6,下列说法中正确的是
| A.秋水仙碱由碳、氢、氧三种元素组成 |
| B.秋水仙碱中氢元素的质量分数最大 |
| C.一个秋水仙碱分子由22个碳原子、25个氢原子、1个氮原子和3个氧分子构成 |
| D.秋水仙碱分子中碳、氢、氮、氧原子个数比为22︰25︰1︰6 |
火星大气中含有一种称为硫化羰(羰音tāng)的物质,其化学式为COS。已知硫化羰与二氧化碳的结构相似,但能在氧气中燃烧,下列有关硫化羰的说法正确的是
| A.硫化羰是氧化物 |
| B.硫化羰的化学性质与二氧化碳的化学性质完全相同 |
| C.硫化羰可用作灭火剂 |
| D.硫化羰是由碳元素、氧元素和硫元素三种元素组成的 |
某同学称取的10g石灰石(主要成分为CaCO3)粉末放入装有100克稀盐酸的烧杯中,反应后烧杯中的剩余物质总质量为107.8克,(石灰石中的碳酸钙和稀盐酸刚好完全反应,且石灰石中的杂质不与稀盐酸反应。)
(1)反应中产生二氧化碳的质量为多少g?
(2)石灰石中碳酸钙的质量为多少g?
(3)石灰石中碳酸钙的质量分数是多少?
试题篮
()