学习完金属的化学性质,同学们来到实验室进行锌、铜、银三种金属活动性顺序的探究活动。实验桌上老师提供的药品有:锌片、铜片、银片、硫酸锌溶液、硫酸铜溶液、硝酸银溶液和稀硫酸。
[制定计划]在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、硫酸锌溶液、硝酸银溶液;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液;
你的设计方案是 。
[进行实验]小华同学选用方案三进行如下探究,请你帮他完成表格中的空白(注:表格中实验操作一栏用文字描述或图示表示均可):
实验操作 |
实验现象 |
分析与结论 |
|
。 |
金属活动性:Cu Ag(填“>”或“<”)。 |
|
锌片表面附着一层红色物质,溶液由蓝色逐渐变为无色。 |
金属活动性:Zn Cu(填“>”或“<”),反应的化学方程式为 。 |
[解释与结论]根据上述实验,小华得出三种金属活动性由强到弱的顺序是 。
[反思与评价]探究活动结束后,同学们分享自己的收获与不足,并进行反思:
1.有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论。简要说明其验证方法: 。
2.经过讨论,大家一致认为以上实验方案中,方案 较好。
3.小华提出,试管中的金属可以回收再利用,这样做的意义是 。
[拓展与延伸]好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应一段时间后,过滤,发现滤液呈无色。此时,滤渣中一定含有 ,溶液中离子数目增加的是 。
小亮学完合金后,知道了不锈钢的主要成分是铁,白铜中含有铜和镍(Ni)。他决定探究Fe、Cu、Ni的金属活动性顺序。
(1)[查阅资料]镍能与稀硫酸反应生成能溶于水的NiSO 4,并放出氢气。写出镍与稀硫酸反应的化学方程式: 。
(2)[猜想与假设]根据教材中常见金属的活动性顺序和查阅的资料,对以上三种金属的活动性作出猜想:
猜想①Fe>Ni>Cu;猜想② 。
(3)[实验探究]把用砂纸打磨过的镍片浸入FeSO 4溶液中,过一会儿取出,发现镍片表面无明显变化。证明 (填"猜想①"或"猜想②")成立。
(4)[拓展延伸]用铜片、NiSO 4溶液和 ,通过实验探究也能判断Fe、Cu、Ni的金属活动性顺序。
金属和金属材料与生产生活和社会发展的关系非常密切。
(1)生活中常用铁锅炒菜主要利用了铁的 性;厨房中的铁锅容易生锈,其原因是铁与空气中的 和水等发生了化学反应。
(2)经检测,世界上最大的青铜器“司母戊鼎”中含有铜、锡等金属,某同学为探究铜、锡与铁的金属活动性顺序,设计了如表所示实验(金属片均已打磨,且形状、大小相同,试管中所用5%的稀盐酸体积相同)。
[实验记录与分析]
实验一 |
实验二 |
实验三 |
|
实验操作 |
|
|
|
实验现象 |
立即产生气泡,速率较快 |
无明显现象 |
立即产生气泡,速率较慢 |
实验结论 |
铁、铜、锡的金属活动顺序由强到弱为 。 |
||
[查阅资料]锡元素(Sn)的常见化合价是+2价。根据实验现象推测实验三的试管中锡与盐酸发生反应的化学方程式 。
(3)向m克AgNO3、Cu(NO3)2,Fe(NO3)2的混合溶液中加入Zn粉,充分反应后,过滤所得溶液的质量仍为m克。则下列说法错误的是 (多选)。
A.滤渣中一定有Ag、Cu、Fe
B.滤液中一定没有AgNO3
C.滤液中一定含有Zn(NO3)2、Fe(NO3)2
D.该过程至少发生了三个化学反应
化学是一门以实验为基础的科学,通过实验可以发现和验证化学原理,获得新的化学知识。请回答下列与化学实验有关的问题:
(1)利用课本实验测定空气里氧气的含量。得到氧气的含量小于 ,可能的原因是: 。(写一种即可)
(2)证明铜和铁金属活动性强弱的实验方法是: 。(写一种即可)
(3)在粗盐提纯实验的步骤中多处用到了玻璃棒,写出其中玻璃棒的作用 。(写一种即可)
某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
[查阅资料]
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
[对比实验]
编号 |
操作 |
现象 |
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象 |
乙 |
将表面打磨后的铝丝浸入CuSO4溶液中 |
铝丝表面析出红色固体 |
丙 |
将表面未打磨的铝丝浸入CuCl2溶液中 |
铝丝表面析出红色固体 |
(1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
[猜测与探究]
小组同学针对实验丙的现象,经讨论后猜测:Cl﹣破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 |
现象 |
结论 |
推论 |
(1)向一支试管中再加入NaCl固体 |
铝丝表面析出红色固体 |
氧化铝薄膜被破坏 |
Na+或① 能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 |
② |
氧化铝薄膜未被破坏 |
Na+和SO42﹣都不能破坏氧化铝薄膜 |
[结论与反思]
得出结论:前述猜测 (填“正确”或“不正确”)
总结反思:本次探究充分运用了比较法和控制变量法
某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
[查阅资料]
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
[对比实验]
编号 |
操作 |
现象 |
甲 |
将表面未打磨的铝丝浸入CuSO4溶液中 |
无明显现象 |
乙 |
将表面打磨后的铝丝浸入CuSO4溶液中 |
铝丝表面析出红色固体 |
丙 |
将表面未打磨的铝丝浸入CuCl2溶液中 |
铝丝表面析出红色固体 |
(1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填强”或“弱”)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
[猜测与探究]
小组同学针对实验丙的现象,经讨论后猜测:Cl﹣破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 |
现象 |
结论 |
推论 |
(1)向一支试管中再加入NaCl固体 |
铝丝表面析出红色固体 |
氧化铝薄膜被破坏 |
Na+或① 能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 |
② |
氧化铝薄膜未被破坏 |
Na+和SO42﹣都不能破坏氧化铝薄膜 |
[结论与反思]
得出结论:前述猜测 (填“正确”或“不正确”)
总结反思:本次探究充分运用了比较法和控制变量法
为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式: 。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
[提出问题]铜与浓硫酸反应的生成物是什么?其中气体是什么?
[猜想假设]同学们对产生的气体作出了猜想。
猜想一:氢气;
猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
[查阅资料]
(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应
(2)H2+CuO Cu+H2O
Cu+H2O
[实验探究]师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。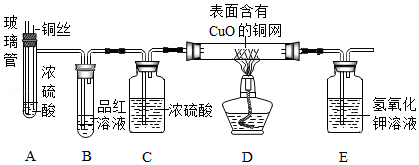
主要实验步骤 |
主要现象 |
解释或结论 |
①加热装置A一段时间 |
装置B中的现象是 |
有二氧化硫生成 |
②点燃装置D处酒精灯 |
装置D玻璃管中无明显现象 |
猜想 正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 |
/ |
/ |
④冷却,将A中液体用水稀释 |
A中液体变为 色 |
有硫酸铜生成 |
[表达交流]
(1)在步骤③中,鼓入空气的目的是 。
(2)请完成铜与浓硫酸反应的化学方程式:
[反思拓展]
(1)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是 。
(2)下列各组药品能够证明锌的活动性比铜强的是 (填序号)。
①锌、铜、稀盐酸②锌、硫酸铜溶液③锌、铜、氯化镁溶液
某课外活动小组进行如下实验探究。

(1)验证物质的燃烧条件
根据图1进行实验,实验现象如图所示。
①80℃热水的作用是 。
②比较现象a、c,得出燃烧的条件是 。
(2)验证锌与铁的金属活动性
①相同条件下,取等质量锌粉、铁粉,根据图2进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是 。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是 (填序号)。
A.左、右两边均有剩余 B.左边有剩余,右边无剩余
C.左、右两边均无剩余 D.左边无剩余,右边有剩余
(3)测定水中氢、氧元素的质量比(已知:H2+CuO Cu+H2O)
Cu+H2O)
根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。

①水中氢、氧元素的质量比是 (用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是 (填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置
手机常用的电池是锂电池。小华同学对锂(Li)元素产生了兴趣,他查看了元素周期表,发现锂是金属单质,原子结构示意图是 。他想了解如果把锂排到金属活动性顺序中应该放在什么位置,于是他去请教老师,老师让他比较锂与镁和锂与钠的金属活动性。于是他针对锂、镁、钠的金属活动性提出猜想。
【提出猜想】猜想一:锂、镁、钠的金属活动性是锂>钠>镁。
猜想二:铝、镁、钠的金属活动性是钠>锂>镁。
猜想三:锂、镁、钠的金属活动性是钠>镁>锂。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| 将体积一样大的锂块和镁块分别加入相同浓度的盐酸中 |
锂与盐酸反应更剧烈,产生气体速率更快 |
锂 (填">"或"<")镁 |
写出锂与盐酸反应的化学方程式:
【理论探究】小华同学认为钠和锂的金属活动性不需要实验也能判定,因为结构决定性质,他研究了钠和锂的原子结构示意图后认为锂 (填">"或"<")钠,理由是 。
【讨论交流】综合实验和理论探究,可以得出猜想 成立。同学们对原子结构示意图进行深入研究,发现从原子结构示意图可以推出元素的化合价,知道金属元素无负价。还可以利用化合价来判定氧化还原反应,化学反应中有元素化合价升降的就一定是氧化还原反应。下列反应就是氧化还原反应,已知水中的氢元素和氧元素的化合价没有变化。
A(单质)+H 2O=B(化合物)+C(化合物)
请回答:A是 (填"金属"或"非金属")单质,原因是 。
试题篮
()