下列实验方案中,能达到实验目的的是:
| 选项 |
实验目的 |
实验方案 |
| A |
除去混入CO2 中的O2 |
通过炽热的木炭层 |
| B |
确认粉末中含有MnO2 和CuO |
加入过量的过氧化氢溶液 |
| C |
从CaCO3 和CaO的混合粉末中得到CaCO3 |
加入足量的稀盐酸,过滤 |
| D |
从AgNO3 和Zn(NO3)2的混合溶液中得到Ag |
加入适量的铜粉,过滤 |
下列实验设计能达到实验目的的是
| 选项 |
A |
B |
C |
D |
| 实 验 设 计 |
 |
 |
 |
 |
| 实验目的 |
验证二氧化碳与水反应生成碳酸 |
确定石蜡成分中含有碳元素 |
探究可燃物燃烧需要氧气和温度达到着火点 |
证明铁生锈是水和氧气共同作用的结果 |
某化学兴趣小组设计四种实验方案来证明炭粉中是否含有氧化铜.其中可行的是:
| A.将固体高温加热,看是否有红色固体生成 |
| B.在样品中加稀硫酸,充分反应后,观察是否有固体剩余 |
| C.在样品中加水,是否有蓝色沉淀 |
| D.在样品中加硫酸,充分反应后,溶液是否呈蓝色 |
下列是某化学学习小组在“人吸入的空气和呼出的气体中有什么不同”的探究活动中提出的一些说法,其中错误的是( )
| A.证明呼出的气体含二氧化碳多的证据是:呼出的气体能使澄清石灰水变浑浊 |
| B.判断呼出的气体含氮气的依据是:空气中含有氮气,而氮气不为人体吸收 |
| C.证明呼出的气体含水蒸气多的证据是:呼出的气体在玻璃片上结下水珠 |
| D.证明呼出的气体含氧气的证据是:呼出的气体能使木条燃烧更旺 |
如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该
| A.得出空气中没有二氧化碳的结论 |
| B.得出空气中含有少量二氧化碳的结论 |
| C.继续用大针筒向澄清石灰水压入空气 |
| D.撤去大针筒,用嘴向澄清石灰水吹气 |
下列装置或操作能达到实验目的的是

A B C D
| A. | 稀释浓硫酸 |
| B. | 探究燃烧的三个条件 |
| C. | 测定空气中氧气的含量 |
| D. | 探究 的性质 |
某无色气体可能含有CO2、CO、H2中的一种或几种。按下表中的步骤连续进行实验(假设每步反应均完全)。
资料:Ⅰ.相同条件下,等体积的气体含有相同数目的分子。
Ⅱ.白色的硫酸铜粉末遇水变蓝。
| 实验步骤 |
实验现象 |
| ①通过炽热的木炭,恢复到原温度 |
气体体积不变 |
| ②通过灼热的氧化铜 |
固体变为红色 |
| ③通过白色的硫酸铜粉末 |
粉末变为蓝色 |
| ④通入澄清的石灰水中 |
石灰水变浑浊 |
下列关于该气体的判断正确的是
A.一定含有CO2、CO和 H2 B.一定含有H2,一定不含CO2和CO
C.一定含有CO2和 H2,可能含有CO D.一定含有CO和 H2,一定不含CO2
下列每组对比实验不能达到实验目的是
| 选项 |
实验设计 |
实验目的 |
|
| 实验一 |
实验二 |
||
| A |
将带火星的木条伸入装有5
5%的过氧化氢溶液的试管中 |
将带火星的木条伸入装有少量
和5
5%的过氧化氢溶液的试管中 |
探究催化剂对化学反应速率的影响 |
| B |
将铁丝放入2
10%的硫酸铜溶液中 |
将银丝放入2
10%的硫酸铜溶液中 |
探究铁、铜、银三种金属的活动性顺序 |
| C |
将5
氯化钠加入20
20℃的水中 |
将5
硝酸钾加入20
10℃的水中 |
比较两种物质溶解度大小 |
| D |
将植物嫩叶浸泡在10
蒸馏水中 |
取10
蒸馏水,通入过量二氧化硫气体,再将植物嫩叶浸泡其中 |
模拟酸雨的危害 |
下列转化不能一步实现的是( )
| A.CO→CO2 | B.H2O→H2 | C.Ca(OH)2→NaOH | D. KNO3→KCl |
某溶液可能含有盐酸、硫酸、硝酸钾、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。下列相关说法正确的是( )

A.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡
B.加入氢氧化钡溶液至过量,共发生了三个化学反应
C.该溶液一定含有盐酸、氯化铜,可能含有硝酸钾
D.到达b点时所消耗氢氧化钡溶液中溶质的质量是34.2g
有一包白色粉末,可能含有Na 2CO 3、Na 2SO 4、K 2SO 4、NaCl、Ba(OH) 2中的一种或几种,为了探究其成分,实验过程如图所示:
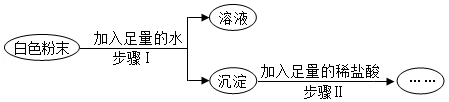
关于该实验的说法正确的是( )
A.步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有Ba(OH. 2、Na 2CO 3、K 2SO 4
B.步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有5种情况
C.步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有Ba(OH. 2、Na 2CO 3,可能有NaCl
D.步骤Ⅱ中沉淀不溶解,则原白色粉末一定有K 2SO 4,一定没有Na 2CO 3
在“人吸入的空气和呼出的气体有什么不同”的探究中,下列说法不正确的是
| A.证明呼出气体含水蒸气较多的证据是:呼出的气体在玻璃上结下水珠 |
| B.证明呼出气体含氧气较少的证据是:呼出的气体使木条燃烧更旺 |
| C.证明呼出气体含有氮气的依据是:空气中含有氮气,而氮气不为人体吸收 |
| D.证明呼出气体含二氧化碳较多的证据是:呼出的气体使澄清石灰水更浑浊 |
小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。
【提出问题】 该淡黄色固体的化学成分是什么?
【查阅资料】
(1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
【设计实验方案】
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,你认为的最佳方案是 ,理由是(从环保或操作角度分析) 。
【实验验证并得出结论】
小明向盛有少量该固体的试管中加入2mL水,立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
小明想对生成的气体成分判断,他提出了以下两种假设:①该气体是CO ②该气体是O2
你认为上述假设哪个更合理 (填“①”或“②”)。
请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
| 操作步骤 |
实验现象 |
结论 |
| |
|
|
【分析】过氧化钠与水反应的文字表达式为 。
【计算】在过氧化钠(Na2O2)中,
①氧元素的化合价为 ;
②过氧化钠的相对分子质量为 ;
③ 过氧化钠中钠、氧元素的质量比为 ;
④78克过氧化钠与多少克二氧化碳中所含氧元素的质量相等?(列式计算)
右图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断错误的是
| A.b管中铁钉不会锈蚀 |
| B.L端与R端液面高度仍然保持一致 |
| C.该实验说明铁锈蚀与空气、水有关 |
| D.若将a管中的水改为食盐水能加快铁的锈蚀 |
试题篮
()