称取一定质量的锌粉与质量分数为20%的稀硫酸若干克混合恰好完全反应,生成氢气1.0g。(反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑)计算:
(1)称取锌粉的质量(2)反应后溶液的总质量。
氮化铝(AlN)被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应制得:Al2O3+N2+3C═2AlN+3CO,现欲制备12.3t氮化铝,需要参加反应的氧化铝(Al2O3)质量是多少?
维生素C是一种人体必需的维生素。查阅资料可知下列信息:
| |
部分性质 |
生理作用 |
| 维生素C 化学式:C6H806 |
无色晶体,易溶于水;在酸性溶液中稳定,中性或碱性溶液中易被空气氧化…… |
促进人体生长发育,增强人体对疾病的抵抗能力…… |
请参与下列问题的讨论。
(1)维生素C中碳、氢、氧三种元素的质量比为 。
(2)某兴趣小组的同学对维生素C的还原性进行实验探究,其实验结果如下图所示。
实验说明了维生素C在空气中氧化除跟氧气有关外,还与 有关。因此,生吃新鲜蔬菜要比熟吃蔬菜维生素C的损失 (选填“大”或“小”)。
(3)①该兴趣小组同学对某果计饮料中维生素C的含量进行测定,反应原理为:
C6H8O6 + I2 ="=" C6H6O6 + 2HI
实验步骤如下:
a.取果汁饮料10 mL,用煮沸并冷却的蒸馏水稀释到50 mL;
b.加醋酸溶液酸化;
c.加人少量指示剂;
d.逐滴加人稀碘水至完全反应,实验测得恰好反应时,消耗溶质碘的质量为25.4mg。计算该果汁饮料每100mL中含维生素C的质量为________mg。
②有些同学在测定时,未加人醋酸溶液酸化,测得维生素C的含量明显小于其他同学。其原因是 。
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(水的密度 1g/cm3),向所得溶液中滴加质量分数 为14.2 %的Na2SO4溶液,至恰好完全反应。右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(1)生成沉淀的质量是 。
(2)所得溶液中溶质的质量分数为多少?
为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
| 试验次序 |
第1次 |
第2次 |
第3次 |
第4次 |
| 所取样品的质量/g |
50.0 |
50.0 |
50.0 |
50.0[ |
| 加入稀硫酸的质量/g |
20.0 |
40.0 |
60.0 |
80.0 |
| 生成气体的质量/g |
0.2 |
0.4 |
0.5 |
0.5 |
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物_________完全反应完了。
(2)50.0g样品与足量稀硫酸反应最多能生成气体_________g。
(3)计算样品中锌的质量分数(写出具体计算过程)。
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。
工业上可用电解饱和食盐水的方法制取氢氧化钠,反应原理是: 2NaCl + 2H2O 通电 2NaOH + Cl2↑+ H2↑ 若电解含氯化钠58.5 t的饱和食盐水,则可制得氢氧化钠多少吨?(写出计算过程)
某班一次社会实践活动是到碱厂参观,该厂主要产品之一是纯碱。参观结束,同学们带回一些化验室里废弃的纯碱样品,来测定其中碳酸钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品12 g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中氯化钠的质量。
(2)所用的稀盐酸溶质质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数。
利用废铁屑与一定质量分数的稀硫酸反应制取硫酸亚铁。现有80g废铁屑与430mL20%的稀硫酸(密度为1.4g/cm3)恰好完全反应(假设废铁屑中除铁以外的物质不溶于水且不与稀硫酸反应)。我能完成下列计算(结果保留整数):
⑴稀硫酸中溶质的质量;
⑵废铁屑中铁的质量;
⑶恰好完全反应时所得溶液中溶质的质量分数。
为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6 g(产生的气体全部逸出)。试计算:
⑴反应生成二氧化碳的质量为 g。
⑵12g样品中碳酸钠的质量为 g。
⑶所得溶液溶质的质量分数(写出计算过程,结果保留一位小数)。
某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
| 加入稀硫酸的质量(g) |
10 |
10 |
10 |
10 |
10 |
10 |
| 剩余固体的质量(g) |
9.35 |
8.7 |
8.05 |
7.4 |
6.75 |
6.75 |
则:(1)黄铜样品中锌的质量分数为 。
(2)所用稀硫酸的溶质质量分数为多少?(写出计算步骤)
石灰石是我省的主要矿产之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如表:
| 实验 |
1 |
2 |
3 |
4 |
| 加入样品的质量/g |
5 |
10 |
15 |
20 |
| 生成CO2的质量/g |
1.76 |
3.52 |
4.4 |
m |
(1)哪几次反应中碳酸钙有剩余?
(2)上表中m的值为 。
(3)试计算这种石灰石中碳酸钙的质量分数。
我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可以用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑铜中的其它杂质)。将30ml稀盐酸分别加入到10g黄铜粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
| |
第一次 |
第二次 |
第三次 |
| 连续加入盐酸的体积/ml |
10 |
10 |
10 |
| 生成氢气的质量/g |
0.108 |
0.108 |
0.04 |
(1)从上表数据分析,小华用10g合金粉末共收集到氢气 g;
(2)求该合金中铜的质量分数。
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如下图所示。若HCl在混合溶液中质量分数为3.65%。求:
(1)A点溶液的溶质化学式为 ;
(2)与盐酸反应的氢氧化钠质量为 g。
(3)恰好沉淀完全时,C点所得溶液中溶质的质量分数是多少?(结果精确到0.1% ,写出计算过程)
过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.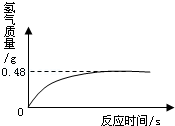
(l)加入二氧化锰的作用是 。
(2)完全反应后生成氧气的质量为 .
(3)计算该溶液中溶质的质量分数.
医学上常用双氧水(H2O2)来清洗创口和局部抗菌。某同学为了测定一瓶医用双氧水溶液的溶质质量分数,取该双氧水68g放入烧杯中,然后加入2g二氧化锰,完全反应后,称得烧杯内剩余物质的总质量为66.8g。请回答下列问题:
(1)生成的氧气为________g;蒸干烧杯内液体,所得固体物质为________g。
(2)试通过计算求该双氧水溶液的溶质质量分数。
试题篮
()