氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
| A.由反应可确定:氧化性HClO3>O2 |
| B.若氯酸分解所得混合气体lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
在FeCl3溶液中加入x g 铜,完全溶解后,再加y g 铁,充分反应得到z g残余固体,且x>z,则下列说法正确的是
| A.残余固体是铜和铁 |
| B.将残余固体加入到稀硫酸中,有气泡产生 |
| C.最后得到的溶液中一定含有Cu2+ |
| D.最后得到的溶液中可能含有Fe3+ |
常温下,下列三个反应均能发生:X2+2W2+===2X-+2W3+; Z2+2X-===2Z-+X2;
2W3++2Y-===2W2++Y2。则在相同条件下,下列三个反应:①Y2+2X-===2Y-+X2;
②Z2+2Y-===2Z-+Y2; ③2W3++2Z-===2W2++Z2也能发生的是
| A.只有① | B.只有② | C.①和② | D.②和③ |
已知:①5Cl2+I2+6H2O===2HIO3+10HCl
②ClO3-+5Cl-+6H+===3Cl2↑+3H2O
下列按物质氧化性顺序由强到弱排列正确的是
| A.Cl2>ClO3->IO3- | B.ClO3->Cl2>IO3- |
| C.ClO3->IO3->Cl2 | D.Cl2>ClO3->IO3- |
常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-;②2Br-+Cl2===Br2+2Cl-;③2Fe3++2I-===2Fe2++I2。
由此判断下列说法错误的是
| A.I-和Cl2不能够发生氧化还原反应 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序为:I->Fe2+>Br->Cl- |
SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程中,下列说法中不正确的是
| A.上述过程中,最终被还原的是NO3— |
| B.从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 |
| C.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1∶1 |
| D.上述过程中,会产生一种无色无味的难溶于水的气体 |
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是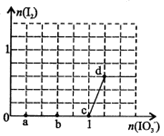
| A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素 |
| B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O |
| C.c点到d点的反应中共转移0.6mol电子 |
| D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O |
下述根据下列操作和现象,所得结论正确的是
| |
实验操作及现象 |
实验结论 |
| A |
分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 |
酸性: CH3COOH > H2CO3> H3BO3 |
| B |
向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 |
溶度积: Ksp(AgCl)<Ksp(AgI) |
| C |
向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 |
证明生成了乙烯 |
| D |
将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 |
氧化性:Br2>I2 |
有一种酸性溶液中存在NO3—、I—、Cl—、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I—,不能确定是否有Cl— |
| B.一定含有NO3— |
| C.可能含有Fe3+ |
| D.一定含有I-、NO3—和Cl— |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。则下列有关说法中不正确的
| A.还原性:I- >Fe2+ >Br- |
| B.原混合溶液中FeBr2的物质的量为6mol |
| C.当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
已知反应①2BrO3-+ Cl2=Br2 +2ClO3- ;②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3-+5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是
| A.Cl2>BrO3->ClO3->IO3- | B.BrO3- >Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.ClO3->BrO3->IO3->Cl2 |
已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl=3Cl2+KCl +3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,
下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeC13溶液 ③Zn与H2SO4溶液 ④Fe与HC1溶液,由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
酸性溶液中粒子还原性顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能实现的是
| A.2Fe3++SO2+2H2O =2Fe2++SO42-+4H+ | B.I2+SO2+2H2O =H2SO4+2HI |
| C.H2O2+H2SO4=SO2+O2+2H2O | D.2Fe3++2I- =2Fe2++I2 |
试题篮
()