常温下,在溶液中可发生以下反应:①2Fe2++ Br2= 2Fe3+ + 2Br-,
②2Br-+ Cl2=Br2 + 2Cl-, ③2Fe3+ + 2I-= 2Fe2++ I2;由此判断下列说法错误的是
| A.铁元素在反应①中被氧化,在③中被还原 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+ |
| D.还原性强弱顺序为:I- > Fe2+ > Br- > Cl- |
己知反应:① PbO2+4HCl=PbCl2+ C12↑+2H2O,②Cu+2Fe3+=Cu2++2Fe2+,③C12↑+2Fe2+="2" Fe3++2Cl-。则有关物质(离子)的氧化性由强到弱的顺序为
| A.Cl2>Fe3+>Cu2+>PbO2 | B.PbO2>Cl2>Fe3+>Cu2+ |
| C.Fe3+>Cu2+>PbO2>Cl2 | D.Cu2+>Fe3+> Cl2>PbO2 |
XeF4在水中发生反应:6XeF4+12H2O=2XeO3+4Xe↑+24HF+3O2↑下列判断中正确的是
| A.XeF4分子具有非常好的热稳定性 |
| B.XeF4分子中Xe的化合价为0价 |
| C.氧化剂和还原剂的物质的量之比为2:3 |
| D.每生成4 molXe转移16 mol电子 |
高锰酸钾制氯气:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 地康法制氯气:4HCl+O2 2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl
2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl MnCl2+Cl2↑+2H2O 下列说法正确的是
MnCl2+Cl2↑+2H2O 下列说法正确的是
| A.实验室常用地康法制氯气 |
| B.氧化性强弱顺序是O2>KMnO4>MnO2 |
| C.氧化性强弱顺序是KMnO4>O2>MnO2 |
| D.氧化性强弱顺序是KMnO4>MnO2>O2 |
下列反应中,硝酸既表现酸性,又表现氧化性的是
| A.Fe2O3跟稀硝酸反应 |
| B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 |
| D.Al(OH)3跟稀硝酸反应 |
在复杂体系中,确认化学反应先后顺序有利于解决问题.下列反应先后顺序判断正确的是
| A.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入Zn: Ag+、Cu2+、H+、Fe2+ |
| B.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸: AlO2-、Al(OH)3、OH-、CO32- |
| C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2: KOH、Ba(OH)2、BaCO3 |
| D.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
| A.氧化性:H2SeO4>Cl2>H2SO3 |
| B.酸性:H2SO4>H2SeO4 |
| C.析出1mol硒需要消耗标准状况下22.4 L SO2 |
| D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |
在常温下发生下列反应:
①16H++10Z-+2XO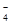 ="=" 2X2++5Z2+8H2O
="=" 2X2++5Z2+8H2O
②2A2++B2 ="=" 2A3++2B-
③2B-+Z2 ="=" B2+2Z-,根据上述反应,判断下列结论中错误的是( )
| A.溶液中可能发生反应:Z2+2A2+=2A3++2Z- |
| B.Z在①③反应中作还原剂 |
C.氧化性强弱顺序为XO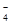 >Z2>B2>A3+ >Z2>B2>A3+ |
D.X2+是XO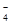 的还原产物 的还原产物 |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,经酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉—KI溶液中,溶液变蓝。
下列判断不正确的是( )
| A.化合物KCrO2中Cr元素为+3价 | B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 | D.实验③证明氧化性:Cr2O72- > I2 |
金属镍有广泛的用途。粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用NiSO4作电解质溶液)。已知:氧化性Fe2+<Ni2+<Cu2+,下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2+2e=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ |
| D.电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
根据下列三个反应判断有关物质(或微粒)还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO十+2H2O+Fe(NO3)3
| A.H2SO3 >I-> Fe2+ >NO | B.I->Fe2+> H2SO3 >NO |
| C.Fe2+ >I-> H2SO3 >NO | D.NO>Fe2+>H2SO3 >I- |
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A.该反应的氧化剂只有CuSO4 |
| B.SO42﹣既不是氧化产物也不是还原产物 |
C.1molCuSO4氧化了 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
溴乙烷与NaOH溶液共热后,加入AgNO3溶液 |
未出现淡黄色沉淀 |
溴乙烷没有水解 |
| C |
向等浓度的KCl、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgCl)<Ksp(AgI) |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静止 |
下层液体显紫红色 |
氧化性:Fe3+>I2 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 → b O2↑+ c Cl2↑+ d HClO4+ e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法错误的是
| A.由反应可确定:氧化性HClO3>HClO4 |
| B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+ I2+ 6H2O→ 12H++ 8Cl-+ 2IO3- |
| C.若氯酸分解所得的混合气体的平均摩尔质量为47.6g/ mol,则反应方程式可表示为:26HClO3 → 15O2↑+ 8C12↑+ 10HClO4+ 8H2O |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
试题篮
()