有下列三个氧化还原反应:①2FeCl3+2KI=2KCl+2FeCl2+I2②2FeCl2+Cl2═2FeCl3③2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑若某FeCl2溶液中有I-共存,要氧化除去I-而又不减少Fe2+和Cl-,可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
| A.2 4 3 2 2 6 | B.0 2 1 0 1 2 |
| C.2 0 1 2 0 2 | D.2 2 2 2 1 4 |
下列说法正确的是()
| A.阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| B.已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为: Fe3+>Cu2+>Fe2+ |
| C.化学反应中,得电子越多的氧化剂,其氧化性就越强 |
| D.已知还原性:B->C->D-,反应2C-+D2=2D-+C2和反应2C-+B2=2B-+C2都能发生 |
已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-,②2FeCl2+Cl2=2FeCl3,③2FeCl3+2KI═2FeCl2+2KCl+I2,④ClO3-+5Cl-+6H+═3Cl2+3H2O,下列各微粒氧化能力由强到弱的顺序正确的是
| A.ClO3->BrO3->Cl2>Fe3+>I2 |
| B.BrO3->Cl 2>ClO3->I2>Fe3+ |
| C.BrO3->ClO3->Cl2>Fe3+>I2 |
| D.BrO3->ClO3->Fe3+>Cl2>I2 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
| A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2 |
| B.通入SO2时,SO2与I2反应,I2作还原剂 |
| C.通入SO2后溶液逐渐变成无色,体现了SO2的还原性 |
| D.滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
则下列物质的氧化性由弱到强排列的顺序正确的是
A.I2,H2O2,KMnO4, NaBiO3 B.H2O2,I2,NaBiO3,KMnO4
C.NaBiO3,KMnO4,H2O2,I2 D.KMnO4,NaBiO3,I2,H2O2
在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I-,不能含有Cl- | B.可能含有Cl-、NO3-和I- |
| C.可能含有NO3- | D.不含有Fe3+ |
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
| A.氧化性:Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA |
| D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
| A.氧化性:H2SeO4>Cl2>H2SO3 |
| B.酸性:H2SO4>H2SeO4 |
| C.析出1mol硒需要消耗标准状况下22.4 L SO2 |
| D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |
已知在常温下,存在下列化学反应:
2KMnO4+16HCl ═2KCl+2MnCl2+5Cl2↑+8H2O
2FeCl3+2KI ═2FeCl2+2KCl+I2
2FeCl2+Cl2 ═2FeCl3
则下列各物质还原性由强到弱排列的顺序正确的是
| A.I-,Fe2+,Cl-,Mn2+ | B.Cl-,Mn2+,I-,Fe2+ |
| C.Mn2+,Cl-,I-,Fe2+ | D.MnO4-,Cl2,Fe3+,I2 |
己知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是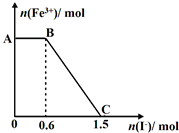
| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25 mol |
| D.K2Cr2O7可与FeSO4反应的物质的量为1:3 |
常温下,在溶液中可发生以下反应:①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2。由此判断下列说法错误的是
| A.铁元素在反应①和③中均被氧化 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序:I->Fe2+>Br->Cl- |
(并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价升降的化学反应都是氧化还原反应。现在如下氧化还原反应,回答下列问题:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)氧化剂是_________,氧化产物是________
(2)未变价元素是_______,将反应成离子方程式________
(3)用单线桥表示转移的电子数:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)氧化产物和还原产物的质量之比为___________________
(5)反应中生成3.6gH2O,转移电子数为_______个。
(6)已知铵盐受热易分解,硝酸铵在一定条件下发生的分解反应为:5NH4NO3=2HNO3+4N2↑+9H2O,当生成还原产物0.6mol时,转移的电子的物质的量是_________mol。
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2(已知Br2 能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16mol/L | B.0.02mol/L | C.0.20mol/L | D.0.25mol/L |
试题篮
()